Зачем нужен гемоглобин?
Практически всем видам позвоночных животных для транспорта кислорода к тканям необходима специальная система доставки, поскольку молекулярный кислород плохо растворим в воде: в 1 л плазмы крови растворяется всего лишь 3,2 мл О2. Содержащийся в эритроцитах позвоночных белок гемоглобин (Hb, рис. 1) способен связать в 70 раз больше — 220 мл О2/л. Содержание Hb в крови человека варьирует в пределах 120–180 г/л, что вдвое выше, чем концентрация белков плазмы (50–80 г/л). Поэтому гемоглобин вносит наибольший вклад в поддержание рН-буферной емкости крови. По своей структуре гемоглобин взрослого человека (HbA) является тетрамером, состоящим из двух α- и двух β-субьединиц с молекулярными массами около 16 кДа. α- и β-цепи отличаются аминокислотной последовательностью, но имеют сходную конформацию.
Рисунок 1. Молекула гемоглобина. Гемоглобин является одним из наиболее хорошо изученных белков. Он был открыт немецким физиологом Отто Функе в 1851 году, а структуру этого белка описал австрийский молекулярный биолог Макс Перутц в 1959 году, за что тремя годами позднее получил Нобелевскую премию по химии [1].
Visual Science
Рисунок 2. Насыщение гемоглобина и миоглобина кислородом
[2]
Каждая субъединица гемоглобина несет группу гема с ионом двухвалентного железа в центре. При связывании O2 с атомом железа в геме (оксигенация Hb) и отщеплении O2 (дезоксигенация) степень окисления атома железа не меняется. Окисление Fe2+ до Fe3+ в геме носит случайный характер. Окисленная форма гемоглобина — метгемоглобин — не способна переносить O2. Доля метгемоглобина поддерживается ферментами на низком уровне и составляет 1–2% [2]. Центры связывания O2 на каждой из четырёх субъединиц действуют кооперативно: когда молекула O2 связывается с одним из них, у других возрастает сродство к кислороду (данное явление называют положительной кооперативностью) [3]. Вследствие этого кривая насыщения гемоглобина кислородом имеет ярко выраженный сигмоидальный характер (рис. 2, кривая 2).
Другой мышечный белок — миоглобин, являющийся эволюционным предшественником гемоглобина, — является мономером и содержит единственный центр связывания O2, из-за чего его кривая насыщения кислородом несигмоидальна (рис. 2, кривая 1). Сродство к кислороду у миоглобина примерно в 13 раз выше, чем у гемоглобина (50%-насыщение миоглобина O2 достигается уже при парциальном давлении кислорода в 1–2 мм рт. ст., в то время как для гемоглобина эта цифра равна 26 мм рт. ст.) [4]. Из-за этого гемоглобин способен эффективно отдавать кислород в тканях и является более эффективным переносчиком, чем миоглобин. Но из этого не следует, что миоглобин малоэффективный и плохо устроенный белок, поскольку он выполняет принципиально иную биологическую функцию — запасание кислорода и обеспечение им митохондрий. Данные адаптивные различия между миоглобином и гемоглобином появились в результате миллионов лет эволюции…
Какой уровень гемоглобина считается нормальным?
Для взрослого мужчины норма гемоглобина составляет 130-160 г/л крови, для взрослой женщины — 120-140 г/л.
Фото: istockphoto.com
Для детей нормой считаются такие значения:
- новорождённые дети до двух недель жизни — не ниже 150 г/л;
- дети от двух до четырёх недель жизни — 120 г/л и выше;
- дети возрастом от шести до 59 месяцев — 110-140 г/л;
- дети возрастом от пяти до 11 лет — 115-140 г/л;
- дети возрастом от 12 до 14 лет — 120-150 г/л;
- дети старше 15 лет — 130-160 г/л.
Прозрачные рыбы
В 1927 году экспедицией норвежских китобоев близ острова Буве во время очередной промысловой охоты была поднята на сушу невиданная рыба, практически бесцветная и, самое интересное, с прозрачной («стеклянной») кровью. Это был первый обнаруженный вид позвоночных, не содержащих белка гемоглобина. За счет поразительного сходства головы рыбы с головой крокодила, рыбу назвали крокодиловая белокровка (Chaenocephalus aceratus). Белокровки (Channichthyidae; рис. 3) или ледяные рыбы обитают в холодных водах возле Антарктиды и южного побережья Южной Америки. Температура воды в этих краях опускается аж до −1,9 °C (температура замерзания морской воды ниже, чем пресной), причем является довольно постоянной.

Рисунок 3. Некоторые представители белокровок. а — Chaenodraco wilsoni. б — Chaenocephalus aceratus. в — Champsocephalus gunnari. г — Cryodraco atkinsoni. Белокровки (Channichthyidae) — семейство из отряда Окунеобразные (Perciformes), в котором описано 16 видов. Данные рыбы питаются крилем, рачками и другими рыбами. Недавние исследования показали, что рацион этих рыб различается в зависимости от возраста. В целом, в рационе преобладает антарктический криль (Euphausia superba) и равноногие рачки (Themisto gaudichaudii). В рационе молодых особей преобладает Т. gaudichaudii и эвфаузииды (Thyanoessa sp.), а доля антарктического криля меньше. Ледяные рыбы достигают общей длины 25–75 см. Они являются пелагиальными представителями антарктических вод, обитают на глубине от 200 до 700 метров. Некоторые подвиды C. aceratus обнаруживаются в районе 1–2 тыс. метров. Белокровки — доминирующий вид в Антарктиде, полностью лишенный плавательного пузыря, в связи с чем многие виды этих рыб являются донными.
[5–8]
Очень немногие рыбы могут выжить в суровых условиях Антарктики. Ледяная рыба выживает за счет специального антифриза, присутствующего в крови и предотвращающего образование кристаллов льда в организме. Этот антифриз (AFGP, antifreeze glycoprotein) представляет собой гликопротеин, предположительно произошедший от панкреатической трипсиногеноподобной протеазы [9]. AFGP способен связываться с микроскопическими кристалликами льда и предотвращать их рост [10].
Ледяные рыбы имеют очень низкий уровень метаболизма и проводят большую часть времени практически неподвижно. Белокровки обитают в богатой кислородом воде и поглощают его непосредственно через кожу [11], потому что при пониженных температурах кровь, содержащая гемоглобин, становится очень вязкой, и выживание с такой кровью было бы весьма проблематично.
Отсутствие гемоглобина компенсируется модификацией сердечнососудистой системы. Все представители ледяных рыб имеют большее сердце, чем у других рыб такого же размера, а это увеличивает ударный объем, в несколько раз повышает общее количество циркулирующей крови и поднимает скорость кровотока. При низком артериальном давлении это достигается за счет снижения системного сопротивления потоку. Сочетание высокой пропускной способности сердечнососудистой системы, высокого содержания кислорода и относительно низких скоростей метаболизма ледяной рыбы позволяет обеспечить достаточное количество кислорода в тканях [12].
Гемоглобиновая потеря
Белокровки пережили потерю генов гемоглобина достаточно давно. Как показывает молекулярный анализ, почти у всех ледяных рыб одна мутация привела к потере гена, кодирующего β-цепь и часть α-цепи гемоглобина. Потеря способности к синтезу гемоглобина вызвала развитие компенсаторных изменений: увеличился объем сердца и общий объем крови (приблизительно в 3.5 раза по сравнению с костистыми рыбами аналогичного размера) [13–15]. Ученые, проанализировав ДНК представителей нототениевых рыб, пришли к выводу, что только у одного вида белокровок (Neopagetopsis iona) присутствуют гены гемоглобина, но они не являются функциональными [16].
Наряду с гемоглобином, у белокровок отсутствует и миоглобин, переносящий кислород в скелетных мышцах. При этом у десяти видов миоглобин сохранился только в сердечной мышце (в частности, в желудочке) [17], а у шести видов миоглобин был утрачен и там, причем механизм утраты гена у каждого вида индивидуален [18]. Общим механизмом подобной утраты является дупликация коротких (5–25-нуклеотидных) фрагментов, приводящая к сдвигу рамки считывания, преждевременной терминации транскрипции, появлению ложного сигнала полиаденилирования или нарушению связывания РНК-полимеразы с промоторной областью ДНК [19], [20].
Утрата гемоглобина первоначально должна была стать адаптацией к холоду: известно, что растворимость кислорода в холодной воде выше [21], а значит, потребность в гемоглобине, напротив, меньше. Отсутствие эритроцитов также снижает вязкость крови, что особенно критично в условиях экстремально низкой температуры. В процессе эволюции у белокровок произошли довольно радикальные изменения, компенсирующие утрату гемоглобина, включая вдвое большие энергозатраты по перекачке крови по сравнению с другими рыбами [22].
Ледяные рыбы произошли от малоподвижного донного предка. В холодных, хорошо перемешиваемых, богатых кислородом антарктических водах рыбы с низкой скоростью метаболизма могут выжить даже без гемоглобина. В середине третичного периода экологический кризис в Южном океане, вызванный похолоданием [23], привел к появлению обширных пустующих экологических ниш. Отсутствие конкуренции позволило мутантам, не имеющим гемоглобина, оставить после себя потомство, которое заселило пустые места обитания. У детенышей развились механизмы компенсации мутаций. В относительно изолированных фьордах образовались места обитания, которые колонизировали несколько особей, что привело к возникновению шести видов рыб, изолированных друг от друга и независимо потерявших гены глобинов [22].
Гистологически показано, что особенностью ледяных рыб является высокий объем митохондрий при сходном их количестве и высокое отношение липид/белок в митохондриальных мембранах в сравнении с близкородственными видами семейства нототениевых рыб (рис. 4). Интересно, что у белокровок, у которых отсутствует миоглобин в скелетной мускулатуре, но присутствует в сердечной, объем митохондрий в скелетных мышцах существенно выше, чем в миокарде. О молекулярных механизмах этого феномена известно довольно мало. Предположительно, это явление связанно с одним из ключевых белков-регуляторов биогенеза митохондрий PGC-1α [23].
PGC-1α является транскрипционным коактиватором и центральным звеном образования митохондрий в клетках. Недавно открыто, что PGC-1α регулирует состав и функции отдельных митохондрий и их окислительный метаболизм. Повышение окислительного метаболизма связано с повышенной работой PGC-1α, что сопровождается увеличением активных форм кислорода (АФК) в митохондриях. Но этот белок является и мощным регулятором удаления АФК, потому что высокий уровень PGC-1α запускает экспрессию многочисленных ферментов-антиоксидантов [25].
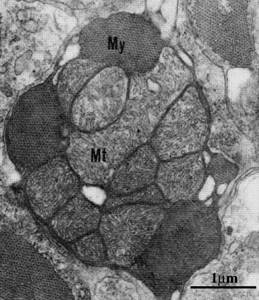
Рисунок 4. Поперечный разрез миоцитов желудочков сердца (C. aceratus). Большие митохондрии (Mt) по периферии окружены миофибриллами (My).
[24]
Регулятором биогенеза мембран митохондрий у белокровок является оксид азота-II (NO) (рис. 5). По сравнению с другими рыбами, у белокровок наблюдается повышенное содержание этого сигнального агента в крови. В ответ на потерю гемоглобина и миоглобина в мышцах ледяных рыб увеличивается биосинтез фосфолипидов, причем, независимо от синтеза митохондриальных белков и репликации митохондриальной ДНК, это приводит к увеличению размера митохондрий. Молекула NO стимулирует образование PGC-1α, который регулирует репликацию митохондриальной ДНК. Но ничего не известно о том, как биосинтез митохондриальных фосфолипидов интегрирован в этот процесс у ледяных рыб; возможно, это индуцируется высоким уровнем NO (темная стрелка на рисунке) [18].
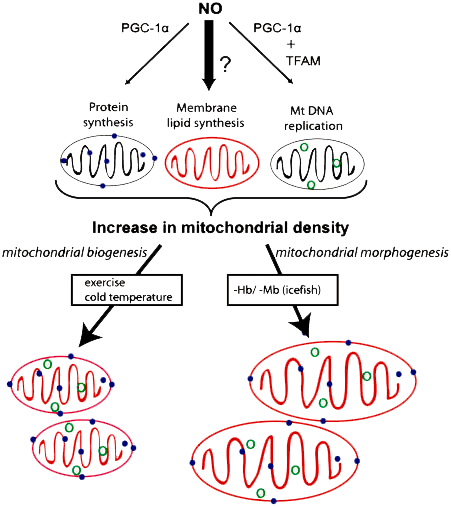
Рисунок 5. Процесс биогенеза митохондрий у ледяных рыб. Образование митохондрий включает в себя синтез митохондриальных белков (синие точки), фосфолипидов и репликацию митохондриального генома (зеленые кружки). В ответ на стимулы, такие как понижение температуры (или повышение физической нагрузки у млекопитающих) эти три компонента митохондриального биогенеза согласованно активируется, что приводит к увеличению плотности митохондрий.
[18]
Гемоглобин: вопросы нормы
Что такое гемоглобин? На что влияет уровень гемоглобина?
Что такое гемоглобин?
Гемоглобин входит в состав эритроцитов или красных кровяных телец. Состоит гемоглобин из белка и железа, именно оно придает крови красный цвет. Гемоглобин важен для снабжения кислородом всех тканей организма. Он также поддерживает кислотность крови. Гемоглобин нужен не только для поддержания обмена веществ в организме. Он является индикатором многих состояний. Для чего выделяют формы гемоглобина:
- гликозированный гемоглобин — продукт присоединения глюкозы. Повышение уровня гликозированного гемоглобина указывает на риск развития сахарного диабета. Норма гликозированного гемоглобина составляет 4-6% от общего гемоглобина.
- фетальный гемоглобин — присутствует только в крови детей. Уровень фетального гемоглобина падает после одного года жизни. Этот показатель говорит о серьезных болезнях у взрослых людей (если превышает 1%).
Гемоглобин у детей до одного года незначительно снижается со дня рождения. Если на первые сутки он составляет до 25 г на дл, то уже к 11месяцам достигает 13 г/дл. И это является нормой гемоглобина для детей. Гемоглобин у женщин всегда ниже, чем гемоглобин у мужчин. Уровень гемоглобина в возрасте от 18 до 45 лет составляет 11,7 – 15,5 и 13,2-17,3 г/дл соответственно.
На что влияет уровень гемоглобина?
Уровень гемоглобина является диагностическим показателем для многих заболеваний и состояний. Повышение гемоглобина может указывать на увеличение образования эритроцитов в крови (эритроцитоз), врожденные пороки сердца, кишечную непроходимость. Гемоглобин высокий характерен для сердечной недостаточности и для сгущения крови. Однако повышение гемоглобина происходит и при самых рядовых событиях, например, во время прогулки на свежем воздухе или после физической нагрузки. Гемоглобин высокий наблюдается у людей, проживающих в горах, или у альпинистов. Пониженный гемоглобин приводит к развитию анемии. При низком гемоглобине человек ощущает постоянную усталость, отличается бледностью, сухой кожей. Снижение гемоглобина приводит к головным болям, выпадению волос, резям в глазах и плохому сну. Нехватка веществ, принимающих участие в выработке эритроцитов, может вызвать снижение гемоглобина. Чаще всего на пониженный гемоглобин влияет нехватка в организме железа, витамина В и фолиевой кислоты. Однако гемоглобин низкий становится и признаком серьезных заболеваний крови, связанных с усиленным распадом эритроцитов или с их плохим образованием в костном мозге. Гемоглобин при беременности зачастую понижается, что связано с увеличением потребности в железе и других питательных веществах. При этом норма гемоглобина при беременности соответствует норме гемоглобина у женщин. Гемоглобин важен для развития плода и его снабжения кислородом. Потому на протяжении всей беременности женщина должна следить за уровнем гемоглобина. В этом помогают регулярные прогулки, разнообразное меню (печень, рыба, черный хлеб, гречка, миндаль и яйца — должны присутствовать в рационе). Физиологическая анемия после 30 недели беременности связана с увеличением объема крови. Продукты, повышающие гемоглобин — являются первым лекарственным средством при низком гемоглобине у детей. Ведь нехватка железа и витаминов может отразиться на умственном и физическом развитии ребенка. При низком гемоглобине дети становятся вялыми, у них ухудшается успеваемость, снижается уровень физической активности, повышается сонливость. Принимать препараты для повышения уровня гемоглобина можно лишь по назначению врача. К ним относятся: средства, содержащие железо (мальтофер, сорбифер) или средства, поднимающие усвоение железа (аскорбиновая кислота, фолиевая кислота).
Источник:
Медстрим.ру