Тело человека населено триллионами микроорганизмов, совокупность которых называют микробиомом. Микробиом выполняет множество важных функций — от синтеза витаминов до расщепления сложных компонентов пищи. «Здоровая» микрофлора постоянно конкурирует за ограниченные питательные ресурсы с патогенными микроорганизмами, тем самым подавляя их рост. Однако из-за приема антибиотиков или других причин нормальный состав микробиома может нарушаться, и тогда патогены получают возможность размножаться неконтролируемо, вызывая болезни. Один из таких патогенов — бактерия Clostridium difficile, возбудитель псевдомембранозного колита. Борьба с С. difficile осложняется ее устойчивостью к большинству известных антибиотиков. Но недавно было показано, что рост С. difficile можно успешно подавлять не лекарствами, а при помощи родственного ему вида — С. scindens. Это открытие послужит основой для создания «умных» лекарств-пробиотиков: эффективных против С. difficile, но безопасных для полезной микрофлоры.
Рисунок 1. Корреляция между присутствием конкретных бактериальных таксонов в микробиоме и устойчивостью к заражению C. difficile [3].
Антибиотики эффективны в борьбе со множеством смертельных заболеваний, но вместе с тем они наносят существенный урон микробиому человека. После курса антибиотиков человек, как правило, более подвержен заражению различными патогенами. Clostridium difficile — грамположительная подвижная бактерия, основной возбудитель острых внутрибольничных кишечных инфекций. За последние 15 лет число смертельных случаев, обусловленных размножением С. difficile, возросло по меньшей мере в 10 раз, особенно среди пожилых и ослабленных людей [1]. Борьба с С. difficile осложняется тем, что при неблагоприятных условиях этот вид образует споры, выдерживающие действие антибиотиков. Такая особенность позволяет бактериям повторно колонизировать кишечник спустя несколько недель и даже месяцев после окончания лечения.
Недавно было показано, что трансплантация микробиомов здоровых доноров вылечивает тяжелые инфекции C. difficile [2]. Однако оставалось неизвестным, какие именно члены микробиома восстанавливают устойчивость организма к инфекции C. difficile и какими механизмами. И вот наконец вышла статья, которая проливает свет на довольно необычный механизм межвидовых взаимодействий в микробиоме [3].
О мышах и людях
C. difficile — не только человеческая беда, но и мышиная. Для начала микробиомы мышей пробовали травить разными антибиотиками и смотрели, как от этого меняется восприимчивость к C. difficile. В целом антибиотики не столько уменьшают суммарное число бактерий в кишечнике, сколько существенно нарушают расстановку сил — соотношение разных таксономических групп. Оказалось, что восприимчивость к C. difficile четко коррелирует с общим снижением видового разнообразия микробима. Удалось выделить горстку из 11 условных видов (операционных таксономических единиц), ассоциированных с устойчивостью к заражению C. difficile (рис. 1). Многие из них оказались тоже клостридиями (кластер Clostridium XIVa). Ученые обратили внимание на один таксон, присутствие которого сильнее всего коррелировало с резистентностью к C. difficile, даже у животных с экстремально низким видовым разнообразием микробиома. Героем оказался Clostridium scindens.
Рисунок 2. Корреляция между приживлением видов-кандидатов в микробиоме и устойчивостью к C. difficile [3].
Но то у мышей. Как же обстоят дела у человека? Для определения видов, связанных с устойчивостью к инфекции C. difficile, исследовали микробиомы пациентов, перенесших аллогеную трансплантацию гемопоэтических стволовых клеток. Большинство из них проходило химиотерапию и/или лучевую терапию одновременно с курсом антибиотиков во время трансплантации. Ослабленный иммунитет и снижение видового разнообразия микробиома делают этих пациентов легкой мишенью для C. difficile. У человека удалось найти два основных вида, с которыми не уживались C. difficile. Наиболее сильным ингибитором оказался C. scindens, как и у мышей. Как будто бы победа?
Для проверки ингибирующего эффекта C. scindens вместе с несколькими другими перспективными бактериями запустили в кишечники животных, недавно принимавших антибиотики (рис. 2). Оказалось, что такая микробная трансплантация существенно облегчила течение инфекции, вызванной C. difficile, а также положительно сказалась на снижении смертности и увеличении массы тела по сравнению с контролем. Наиболее заметную устойчивость к C. difficile обеспечивал, как и ожидалось, C. scindens. Приживление трасплантированных бактерий в микробиоме отслеживали по наличию гена соответствующей 16S рРНК. Устойчивость к C. difficile росла прямо пропорционально обилию C. scindens. То есть улучшение приживаемости C. scindens может повысить защиту против C. difficile. Примечательно, что такая аккуратная замена плохой клостридии на очень похожую, но хорошую, не нарушает существующий в микробиоме баланс (ни качественный, ни количественный). Своеобразная антидотная терапия, только на уровне микробиома. Все это открывает искрящиеся горизонты для разработки безопасных лекарств против C. difficile. Но как именно C. scindens противостоит C. difficile?
Клостридии. Всегда рядом, всегда начеку
Назад к списку Предыдущая статья Следующая статья
11.07.2012
Метки:
бактерии, клостридии, микрофлора
(7 оценок, среднее: 4,71 из 5)
Ботулизм, столбняк, газовая гангрена… Об этих заболеваниях наслышаны если не все, то очень многие люди. Но если от столбняка существуют вакцины, например АКДС (адсорбированная коклюшно-дифтерийно-столбнячная сыворотка), то от псевдомембранозного колита, некротического энтерита, ботулизма или газовой гангрены таких вакцин нет. А вызываются все эти заболевания бактериями рода Clostridium.
Одним из наиболее распространенных видов клостридий является Clostridium difficile. Ее высевают из почвы, воды (в том числе и морской). Благодаря возможности образовывать эндоспоры (покрываться оболочкой и переживать неблагоприятный период в состоянии своеобразной «спячки») этот вид может длительно, до двух месяцев, сохраняться во внешней среде. Более того, в состоянии эндоспоры клостридия диффициле выдерживает даже кипячение. Чувствительность к антибиотикам у Clostridium difficile от природы очень низкая, поэтому лечение посредством антибиотикотерапии зачастую терпит фиаско.
Clostridium difficile входит в нормофлору (является представителем нормального микробного состава) желудочно-кишечного тракта, обитая преимущественно в толстом кишечнике. Хотя отдельные его представители встречаются и во рту, и в тонком отделе кишечника, и во влагалище у женщин. Чаще всего Clostridium difficile обнаруживается в кишечнике новорожденных (около половины младенцев), а из детей старше 2 лет и взрослых каждый 10 является обладателем этой бактерии.
Clostridium difficile вызывает такие заболевания как псевдомембранозный колит и антибиотикоассоциированные диареи. Патогенные (болезнетворные) свойства этой клостридии обусловлены выделением токсинов А и В, а также белка, угнетающего перистальтику (сократительную функцию) кишечника.
Антибиотикодиссоциированные диареи (сокращенно – ААД) могут вызываться не только клостридией дифициле, а и множеством других микроорганизмов (сальмонеллами, кандидами, клостридией перфрингенс, золотистым стафилококком, клебсиеллой). Этот вид диарей является наиболее частой внутрибольничной инфекцией и связана такая тенденция с тем, что в больницах, во-первых, концентрируется большая масса больных и здоровых людей. А во-вторых, здесь используется множество антибиотиков и дезинфицирующих средств, которые способствуют образованию генераций (поколений) микроорганизмов, устойчивых к антибиотикам. Поэтому в мире ежегодно регистрируется около миллиона случаев ААД. Возникновение антибиотикоассоциированных диарей связано с тем, что антимикробные препараты подавляют как патогенную, так и нормальную микрофлору. Даже однократный прием антибиотиков широкого спектра действия может послужить причиной развития ААД.
Клостридии
Несмотря на это, дети младенческого возраста практически не болеют антибиотикоассоциированными диареями, вызываемыми клостридией диффициле. Связано это с тем, что дети получают с материнским молоком достаточно иммунных факторов, которые могут сдерживать размножение Clostridium difficile. Более того, в младенческом организме нет такого количества сопутствующей условно-патогенной микрофлоры, которая ослабляет иммунитет.
Антибиотикозависимые диареи могут иметь разную симптоматику и течение: от легкой диареи до тяжелейшего псевдомембранозного энтероколита (ПМК). Последний чаще всего вызывается именно клостридией диффициле.
В процессе течения заболевания отмечаются следующие симптомы:
- частый и обильный водянистый понос, при котором наблюдаются иногда кровянистые, слизистые и гнойные включения;
- лихорадка с высокой температурой (до 40°С);
- боли в животе, которые могут быть как постоянными, так и «схваткообразными».
При отсутствии лечения количество смертельных случаев составляет до 30 %.
Характерная особенность болезней, вызванных Clostridium difficile, является то, что около четверти случаев через время повторяются (рецидив заболевания). Причиной этого явления становятся споры клостридий, которые переживают период лечения, либо повторное заражение. Как правило, после лечения больные выздоравливают, или чувствуют себя значительно лучше, но спустя несколько дней (от 3 до 7) развивается рецидив.
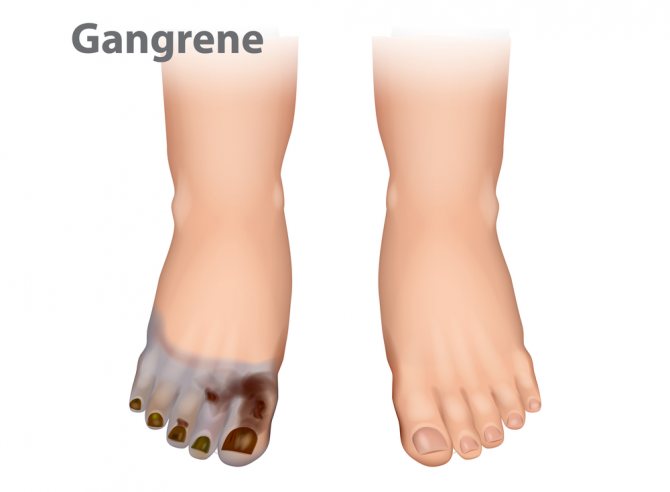
Еще одна клостридия, которая может вызывать такие болезни желудочно-кишечного тракта, как пищевые токсикоинфекции и некротический энтерит, – Clostridium perfringens.
Некротический энтерит характеризуется формированием язв и эрозий и деструктивными (разрушающими) изменениями в слизистой оболочке. Первым симптомом заболевания является возникновение участков геморрагического некроза в начальных отделах тощей кишки. Эти участки имеют красный цвет. Наблюдается также сужение просвета кишечника в месте воспаления, за счет отечности стенки. Происходит тромбоз (закупорка) мелких кровеносных сосудов (артериол). У больного отмечаются озноб и лихорадка, рвота и кровавый пенистый понос.
Clostridium perfringens производит ферменты, расщепляющие белки (протеиназа), коллаген (коллагеназа), гиалуроновую кислоту (гиалуронидаза).
Гангрена, вызываемся Клостридией
Синтезируют протеиназы, лецитиназу, коллагеназу, гиалуронидазу и другие ферменты агрессивности. Клостридия перфрингенс производит также токсины, среди которых есть растворяющие эритроциты (гемолитические), в частности, ?-токсин, а также белки, способные образовывать отверстия в мембранах клеток кишечника и таким образом вызывать обезвоживание клеток и выход ионов калия.
Профилактика заболеваний, причиной которых являются клостридии, в первую очередь заключается в соблюдении санитарно-гигиенических норм и правил: мытье и ошпаривание овощей и фруктов; длительная термическая обработка. Но немаловажным является также нормализация микрофлоры и укрепление иммунитета. Причем, как в процессе лечения, так и в процессе предупреждения этих болезней. Ограниченное и строго подконтрольное врачам применение антибиотиков, отказ от самолечения также очень важны для профилактики возникновения АДД и других болезней, связанных с клостридиями.
Назад к списку Предыдущая статья Следующая статья
Механизм ингибирующего действия
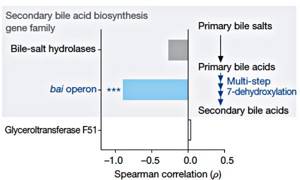
Рисунок 3. Корреляция между устойчивостью к C. difficile и наличием семейств генов, необходимых для синтеза вторичных желчных кислот [3].
Известно, что некоторые вторичные желчные кислоты могут ухудшать рост C. difficile in vitro [4]. У очень большого числа микробиомных бактерий есть ген bsh, кодирующий гидролазу желчных кислот. Однако у редкой бактерии (ужасно малой доли микробиомных организмов) есть все гены, необходимые для осуществления полного пути биосинтеза желчных кислот. Редкой бактерией, конечно же, оказалась C. scindens, обладающая критическим для синтеза вторичных желчных кислот геном 7α-гидроксистероид-дегидрогеназы (рис. 3). Именно на этой уникальной биохимической особенности и зиждется защитный механизм C. scindens против C. difficile. Внедрение C. scindens в микробиом животных, восприимчивых к C. difficile, восстанавливает необходимый уровень и соотношение вторичных желчных кислот: дезоксихолевой (DCA) и литохолевой (LCA). Обе эти кислоты подавляют рост C. difficile пропорционально своей концентрации. Примечательно, что C. scindens повышает количество вторичных желчных кислот до физиологического уровня и препятствует росту C. difficile даже у животных, прошедших курс антибиотикотерапии. Этот механизм консервативен — реализуется как в микробиоме мыши, так и в микробиоме человека.
В каких случаях обычно назначают исследование
Анализ на токсины клостридий назначают при следующих состояниях:
- диарея у пациентов, принимающих или проходивших курс антибиотиков (особенно после клиндамицина, линкомицина, синтетических пенициллинов, цефалоспоринов), а также диарея у поступивших в стационар спустя 72 часа после госпитализации;
- подозрение на псевдомембранозный колит у пациентов, относящихся к группе высокого риска: старше 65 лет, длительная госпитализация, проведение хирургических операций, наличие злокачественных опухолей, почечная недостаточность, воспалительные заболевания толстой кишки, химиотерапия, гипоальбуминемия.
Терапевтические перспективы
C. scindens подавляет рост C. difficile за счет синтеза вторичных желчных кислот*. Однако применение этих кислот в качестве самостоятельного лекарства небезопасно, так как некоторые из них ассоциируют с развитием рака двенадцатиперстной кишки [5]. Гораздо более эффективно использовать саму C. scindens и поработать, например, над улучшением приживаемости этого вида в микробиоме. Тут могут помочь другие бактерии посредством дополнительных механизмов: соревнования за углеводы с C. difficile, активации иммунной защиты хозяина или продукции антимикробных пептидов. Такой рациональный подход позволит использовать C. scindens в качестве эффективного оружия против C. difficile, не наносящего вред остальному микробиому.
* — О черных делишках кишечных микробов-диверсантов, сокращающих пул желчных кислот и стимулирующих развитие атеросклероза, читайте в статье «Не доверяйте рекламе, или потенциальная связь метаболизма L-карнитина и развития атеросклероза» [6] — Ред.
Литература
- Lucado J., Gould C., Elixhauser A. (2012). Clostridium difficile infections (CDI) in hospital stays. Статистический бриф № 124 (проект Healthcare cost and utilization агентства по исследованиям и контролю качества в здравоохранении (AHRQ), США);
- de Vrieze J. (2013). Medical research. The promise of poop. Science. 341, 954–957;;
- Buffie C.G., Bucci V., Stein R.R., McKenney P.T., Ling L., Gobourne A. et al. (2015). Precision microbiome reconstitution restores bile acid mediated resistance to Clostridium difficile. Nature. 517, 205–208;;
- Sorg J.A., Sonenshein A.L. (2008). Bile salts and glycine as cogerminants for Clostridium difficile spores. J. Bacteriol. 190, 2505–2512;
- Bernstein H., Bernstein C., Payne C.M., Dvorakova K., Garewal H. (2005). Bile acids as carcinogens in human gastrointestinal cancers. Mutat. Res. 589, 47–65;;
- Не доверяйте рекламе, или Потенциальная связь метаболизма L-карнитина и развития атеросклероза.