Кожа является крупнейшим специализированным органом человека, площадь которого составляет 2 м2, а масса — почти 3 кг. Она выполняет ряд важнейших функций. В частности, кожа — это барьерный орган и, что особенно важно отметить, подобно тимусу, она является местом, где созревают некоторые типы иммунных клеток и протекают иммунологические реакции. В принципе, в кожном барьере представлены все типы клеток, способные осуществлять широкий спектриммунных реакций. Это дает основание считать кожу органом иммунной системы.
В начале 80х гг. XX века была сформулирована концепция лимфоидной ткани кожи — skin-associated lymphoid tissue (SALT), которая продолжает развиваться и в наши дни. В соответствии с современными взглядами наряду с лимфоцитами к иммунной системе кожи следует отнести нейтрофилы, тучные клетки и эозинофилы, клетки Лангерганса и кератиноциты [3, 4, 20].
Лимфоциты
Для лимфоидных клеток характерна рециркуляция — постоянный обмен между кровью, лимфой и органами, содержащими лимфоидную ткань. Другой особенностью данной клеточной популяции является хоминг — заселение определенных участков лимфоидных органов и тканей. Поэтому внутридермальные лимфоциты отличаются от циркулирующих в периферической крови. Для изучения популяционного состава лимфоцитов кожи были использованы методы иммуногистохимии и «кожного окна» (определение процентного содержания клеток на отпечатке с небольшого участка кожи после удаления поверхностного слоя эпидермиса). Это позволило установить, что в норме лимфоидные клетки кожи являются преимущественно Т-лимфоцитами: CD5+ — 19%, CD3+ — 48%, CD25+ — 26%, CD4+ — 33%, CD22+ — 18% [7, 14]. Все они имеют достаточно специфичный общий маркер — кожный лимфоцитарный антиген (CLA), который считается рецептором, контролирующим сродство Т-клеток к коже. CLA — это адгезивная молекула на мембране, которая обеспечивает связывание Т-лимфоцита с эндотелием посткапиллярных венул кожи и переход его в дерму. CLA-позитивные T-клетки составляют 10—15% циркулирующих клеток крови. Популяция CLA-позитивных Т-клеток представлена несколькими субпопуляциями, различающимися по рецепторному статусу и функциональной активности [10, 11, 12]. Для всех CLA-позитивных Т-клеток характерна экспрессия кожного Т-клеточного хемоаттрактанта (CTACK), который «привлекает» в кожу Т-лимфоциты из циркуляции, прежде всего при различных воспалительных процессах. Совокупность накопленных сегодня клинико-экспериментальных данных показывает, что CTACK играет важную роль в иммунном ответе кожи. Наиболее значима его патогенетическая роль как провоспалительного фактора при таких заболеваниях, как атопический и контактный дерматиты [13].
Кроме того, большинство Т-лимфоцитов нормальной кожи здорового человека имеют рецепторы к другим хемокинам — биологически активным веществам, контролирующим миграцию клеток, в частности лимфоцитов. Это способствует их активному участию в различных иммунологических реакциях, как физиологических, так и патологических [1, 6, 21].
Т-клетки кожи способны дифференцироваться в цитотоксические клетки или клетки памяти (CD45RO). Клетки памяти экспрессируют также кожный лимфоцитарный антиген (CLA), образуются в лимфатических узлах, дренирующих кожу, и возвращаются в кожу при воспалении. В норме они участвуют в формировании иммунитета в коже, а при патологии принимают участие в патогенезе кожной Т-клеточной лимфомы, отторжения трансплантата, атопического дерматита и т. д. [2, 5, 10, 17]. Около трети лимфоцитов кожи являются Т-хелперами (СD4+). В последние годы показано, что данная субпопуляция клеток представлена двумя разновидностями —Th1 и Th2, которые различаются прежде всего по спектру продуцируемых цитокинов. В норме между этими клетками существует определенный баланс; при заболеваниях кожи соотношение Th1/Th2 меняется. Например,при воспалительных процессах повышается активность Th1-лимфоцитов [1, 8, 12, 15]. Таким образом, лимфоциты кожи представляют собой гетерогенную клеточную популяцию, в которой присутствуют клетки рециркулирующего пула и специфические кожные лимфоциты. Для последних характерен своеобразный набор клеточных рецепторов, обусловливающих их тропность к коже, а также определенный набор продуцируемых цитокинов, позволяющий им участвовать в различных клеточных реакциях, которые обеспечивают репарацию кожи.
Нейтрофилы
Нейтрофилы содержатся в нормальной коже в незначительном количестве, а при острых воспалительных процессах их число существенно возрастает. Кроме того, нейтрофильные гранулоциты участвуют в регуляции репаративных процессов путем взаимодействия с другими клетками (макрофагами, кератиноцитами). Одним из механизмов этого взаимодействия является продукция нейтрофилокинов, стимулирующих секрецию фибробластами и лимфоцитами факторов роста, которые в свою очередь индуцируют пролиферативную активность клеток регенерирующей ткани [3, 18].
Интерпретация результатов
Увеличение количества RET называют ретикулоцитозом. У взрослых он может свидетельствовать о значительном кровотечении в недавнем прошлом или продолжающейся кровопотере, анемии, гемолизе и других патологиях. Сниженные показатели указывают на то, что нормальный процесс формирования новых эритроцитов нарушен.
У детей нормальные показатели значительно отличаются, в зависимости от возраста. Для младенцев высокие показатели являются нормой, с возрастом они снижаются. В подростковом возрасте нормальные значения существенно отличаются, в зависимости от пола.
Тучные клетки и эозинофилы
Тучные клетки (ТК) и эозинофилы кожи участвуют в различных патологических процессах, прежде всего — в аллергических. При внедрении аллергена в кожу он взаимодействует с эозинофилами и ТК, несущими на своей поверхности IgE-антитела. В результате этого взаимодействия происходит активация и дегрануляция клеток с последующим высвобождением различных медиаторов (субстанции Р, интерлейкинов 1 и 6, хемокинов). Они способствуют миграции в очаг патологического процесса других иммунокомпетентных клеток и поддерживают активность воспалительной реакции. Количество и функциональная активность этих клеток по-разному меняются при различных кожных заболеваниях. Кроме того, ТК и эозинофилы играют определенную роль в реализации патогенных эффектов стресса на кожу [2, 6, 9].
Клетки Лангерганса
Клетки Лангерганса (КЛ) относятся к специализированным клеткам эпидермиса и составляют 2-3% от общего числа его клеток. Они представляют собой одну из форм дендритных клеток, имеющих моноцитарно-макрофагальное происхождение и выполняющих в организме важнейшие иммунные функции, прежде всего — как антигенпрезентирующие клетки. Дендритные клетки являются ключевым звеном, связывающим приобретенный и врожденный иммунитет [16].
При воспалении и других процессах, связанных с антигенной стимуляцией, КЛ приобретают двигательную активность, покидают эпидермис с током тканевой жидкости и, перемещаясь по лимфе, претерпевают определенные морфологические трансформации, в результате чего становятся так называемыми «вуалевыми» клетками. Достигая лимфатических узлов, они активно взаимо действуют с другими иммунокомпетентными клетками и осуществляют презентацию им антигенов. КЛ способны взаимодейство вать с различными типами Т-клеток, модулируя таким образом различные типы иммунных реакций (воспаление, аутоиммунитет). Кроме того, КЛ непосредственно участвуют в уничтожении бактерий в коже.
Расшифровка и нормальные значения основных показателей анализа крови
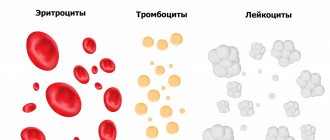
| Как обозначается | Что означает | Норма для женщин | Норма для мужчин |
| RBC | Эритроциты | 3,5-4,5 | 4,0-5,5 |
| WBC | Лейкоциты | 4-9 | |
| PLT | Тромбоциты | 180-320 | |
| HGB | Гемоглобин | 120-140 | 130-170 |
| MCV | Усредненный объем эритроцитов | 82-98 | 81-95 |
| MCH | Усредненный уровень HGB в эритроците | 26-32 | |
| MCHC | Усредненная концентрация эритроцитов в HGB (%) | 31-38 | |
| HCT | Гематокрит (в %) | 35-44 | 40-50 |
| RET | Ретикулоциты (%) | 0,2-1 | |
| ESR | СОЭ (мм/ч) | 2-15 | 1-10 |
| ЦП | Цвет | 0,85-1,05 | |
Цитокины — биорегуляторы иммунных реакций
Последние десятилетия характеризовались бурным накоплением данных о новом классе иммунорегуляторных молекул — цитокинов. Они включают в себя огромное количество различных веществ, в том числе интерлейкинов, которые выполняют коммуникативную функцию между иммуноцитами и оказывают различные регуляторные влияния как в рамках иммунной системы, так и в других органах и тканях. В настоящее время в коже обнаружено большинство известных интерлейкинов: их функции связаны с кожей, а нарушение продукции лежит в основе патогенеза ряда кожных заболеваний, в частности псориаза и атопического дерматита [2, 6, 7].
Какие показатели содержит анализ крови
Сдача крови для исследования необходима при плановой госпитализации, для оценки эффективности проведенной терапии и в период вынашивания ребенка. Чтобы поставить точный диагноз и назначить лечение врач всегда назначает общий анализ крови. Материал для исследования берут из пальца или из вены. Второй вариант предпочтительнее, так как венозная кровь точнее показывает уровень гемоглобина и эритроцитов.
В первую очередь анализируются эритроциты, лейкоциты и тромбоциты, а также:
- Уровень гемоглобина.
- Эритроцитарные индексы.
- Уровень гематокрита.
- Количество ретикулоцитов.
Дополнительно устанавливается скорость оседания эритроцитов (СОЭ), цвет и период свертывания крови.
Расширенное исследование предполагает указание лейкоцитарной формулы, включающей подсчет эозинофилов, лимфоцитов, моноцитов, палочкоядерных, сегментоядерных нейтрофилов.
Иммунная система кожи при инфекционном и неинфекционном поражении
Иммунная система кожи участвует в реализации и врожденного, и приобретенного иммунитета. Наиболее значимо ее роль проявляется при нарушении целостности барьера и проникновении в дерму микро организмов. При этом SALT реагирует как единая функциональная система. В анти-генпрезентирующих клетках происходят процессинг и презентация антигена, в ходе которых КЛ превращаются в дендритные клетки и перемещаются по дерме в лимфатические узлы. В результате они приобретают способность взаимодействовать с Т-хелперами, которые затем активируют В-клетки и частично дифференцируются в эффекторные лимфоциты и клетки памяти. Т-клетки памяти, несущие CLA, способны из кровотока мигрировать в эпидермис; именно они и преобладают в коже. В результате увеличения числа Т-клеток, контактирующих с наиболее «актуальными» антигенами, вносится поправка в антигенраспознающий репертуар Т- лимфоцитов. Этим определяется активность иммунного ответа.
При неинфекционном поражении кожи, например при травме, иммунная система активно участвует в заживлении кожной раны. Заживление кожной раны — это динамичный интерактивный процесс с участием медиаторов, клеток крови, межклеточного матрикса и мезенхимальных клеток, который состоит из трех фаз: воспаление, образование грануляционной ткани и тканевое ремоделирование. Воспаление является реакцией организма в целом и кожи в частности на травму. Ведущая роль в его развитии принадлежит клеткам крови — нейтрофилам. Они не только участвуют в гемостазе, но и выделяют биологически активные вещества.
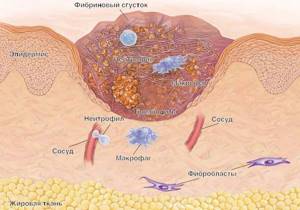
В результате происходит активация моноцитов-макрофагов, которые служат связующим звеном между воспалением и регенерацией. Активация этих клеток приводит к индукции пролиферации эпидермиса. Необходимо отметить, что реэпителизация начинается уже через несколько часов поле нанесения травмы. Первоначально она идет за счет сокращения внутриклеточных тонофиламентов, что повышает миграционную способность эпидермальных клеток. Примерно через четверо суток в ране определяется новообразованная строма (грануляционная ткань). Под влиянием различных цитокинов, продуцируемых иммунокомпетентными клетками, в ней происходят дифференцировка фибробластов, синтез коллагена, новообразование сосудов. Активное участие в этих процессах принимают цитокины, и в том числе — ростовые факторы (эпидермальный, трансформирующий, тромбоцитарный, эндотелиальный и другие). Метаболизм коллагена, появление в грануляционной ткани миофибробластов, пролиферация кератиноцитов и целый ряд других клеточных событий, завершающих «созревание» грануляционной ткани, приводят к формированию кожного рубца, что свидетельствует о восстановлении целостности ткани и завершении репаративного процесса [19, 21].
Таким образом, в коже представлены все типы иммунного ответа — врожденный и приобретенный (адоптивный), клеточный и гуморальный. Благодаря этому возможны и неспецифическая защитная функция (иммуноглобулины, лизоцим, лактоферрин, дефенсины, фагоцитоз), и первичное распознавание антигена с последующей его презентацией и пролиферацией антиген-специфических Т-клеток. В результате в дерме осуществляются как цитотоксические реакции, так и антителообразование. Необходимо подчеркнуть, что особенностью кожи как иммунного органа является относительное преобладание врожденного иммунитета над приобретенным, а в системе врожденного иммунитета кожи в свою очередь превалируют клеточные факторы. Анализ многочисленных научных данных позволяет полагать, что иммунные реакции имеют отношение к большинству физиологических и патологических процессов, происходящих в коже.
Наследование резус-фактора
По словам Дмитрия Окунева, принадлежность крови к каждой из групп (система АВО) и наличие резуса считается генетически обусловленной и неизменной. Наследование резус-фактора кодируется независимо от групп тремя парами генов. Генотип резус-положительного человека бывает гомозиготным — DD или гетерозиготным — Dd. Генотип резус-отрицательного человека — dd.
— Еще во время пребывания малыша в роддоме в 1% случаев встречается гемолитическая болезнь новорожденных — грозное заболевание, сопровождающееся умиранием эритроцитов. Патогенез гемолитической болезни развивается при несовместимости крови матери и плода по резус-фактору и системе АВО, — говорит собеседник «Известий».
Кровь за кровь
Фото: ТАСС/Егор Алеев
Ранняя диагностика гемолитической болезни новорожденных происходит в дородовом периоде. При этом врачи исключают иммунный конфликт матери и плода, определив группу крови и резус-фактор матери и отца. При отрицательном резусе врачи выясняют про ранние беременности, аборты, переливания крови. Во время беременности трижды определяют наличие противорезусных антител и проводят УЗИ.

Тюрьма вместо нобелевки: ученый, спасавший детей от ВИЧ, ломал им гены
Китайский генетик, менявший гены ЭКО-детей, проведет три года за решеткой
Нарушения функции SALT
На обширном экспериментальном и клиническом материале показано, что нарушения функций SALT — реактивности Т-клеток, продукции цитокинов, экспрессии хемокинов на клетках, межклеточных взаимодействий и других иммунологических реакций — приводят к развитию ряда заболеваний, любое из которых сопровождается изменением внешнего вида кожи. Это могут быть воспалительные заболевания кожи (фурункулы, акне), атопический дерматит, псориаз, Т-клеточная кожная лимфома [5, 16, 17]. Известно, что возрастные изменения кожи также связаны с изменением ее иммунологических функций. В стареющей коже наблюдаются мононуклеарная инфильтрация, снижение числа клеток Лангерганса и изменение продукции иммунокомпетентными клетками цитокинов, влияющих на пролиферацию и дифференцировку клеток кожи.
Разнообразие клеток, входящих в иммунную систему кожи, а также многообразие их функций объясняют тот факт, что на уровне кожи возможно проявление всех типов иммунопатологических синдромов (иммунодефицитный, аутоиммунный, аллергический, лимфопролиферативный). Иммунодефицитный синдром проявляется, например, фурункулезом и другими гнойно-воспалительными процессами. При дефектах фагоцитоза кожа становится чувствительной ко многим бактериальным и грибковым инфекциям, но иммунный ответ нарушается на любой антиген, поскольку страдает антигенная презентация.
Аллергический (гиперергический) синдром встречается достаточно часто и имеет место при контактном и атопическом дерматитах. Явления гиперергии характерны и для псориаза. Аутоиммунный синдром также имеет кожные проявления (склеродермия, системная красная волчанка). Примером лимфопролиферативного синдрома служит Т-клеточная лимфома кожи (грибовидный микоз).
Диагностика всех этих состояний основана на клинических признаках. Например, для иммунодефицитного заболевания это будут такие критерии, как рецидивирующее течение инфекционного поражения кожи, его затяжное течение несмотря на проведение адекватной фармакотерапии, тенденция к генерализации инфекционно-воспалительного процесса в коже, резистентность к антимикробной терапии, преобладание в очаге поражения некротических изменений над воспалительными, несоответствие локальных и системных проявлений кожной инфекции. Специфических тестов, характеризующих состояние иммунитета кожи, в практической медицине не существует. Дерматолог может ориентироваться на стандартные иммунологические показатели крови. В научных же исследованиях используют морфологическую (гистологическую) оценку иммунокомпетентных структур кожи, метод «кожного окна» и некоторые другие.
Как улучшить иммунитет кожи?
Патология иммунной системы приводит к развитию иммунозависимой патологии. Поэтому потребность в стимуляции иммунитета кожи при его угнетении патогенетически обоснована. Для этих целей могут быть рекомендованы такие препараты, как Полиоксидоний и Ликопид. Некоторые иммуномодуляторы (например, Рибоксин) могут использоваться как для системного, так и для местного применения, в том числе в мезотерапевтических методиках. При этом интрадермальные иньекции оказывают влияние преимущественно на иммунную систему кожи, а системное применение приводит к активации лимфопоэза в тимусе и лимфатических узлах. Другими словами, выбор способа введения препарата (местное или системное) должен базироваться на характере иммунных нарушений — как в коже, так и в организме в целом.
Умеренным иммунотропным действием обладают и неспецифические адаптогены (витаминно-микроэлементные комплексы, настойка аралии и т. п.). Мы обнаружили иммуноактивные свойства у органического кремния, который широко используется в мезотерапевтической практике. В лечении заболеваний, вызванных повышенной реактивностью иммунной системы (псориаз, лимфомы), используют иммунодепрессанты (циклоспорин). Последним достижением иммунофармакологии является использование в качестве ингибиторов иммунной системы моноклональных (высокоспецифичных) антител.
Улучшая иммунный статус кожи, следует помнить о том, что иммунная система кожи, морфологически представленная SALT, с одной стороны, является достаточно автономным отделом иммунной системы организма, с другой — имеет с ней тесные морфофункциональные и регуляторные взаимоотношения. Нарушения нормальных иммунных реакций в коже приводят к развитию многих дерматологических заболеваний и подавляющего большинства эстетических проблем, в том числе к преждевременному старению кожи. Неудивительно, что кожа является мишенью для иммунотерапевтических вмешательств, в частности иммуномезотерапии. Более подробно этот вопрос мы планируем рассмотреть в следующих публикациях.
Литература
- Белова О. В., Арион В. Я., Сергиенко В. И.Роль цитокинов в иммунологической функции кожи. Иммунопатология, аллергология,инфектология 2008; № 1:41—55.
- Боровик Т. Э., Макарова С. Г., Дарчия С. Н., Гамалеева А. В., Грибакин С. Г.Кожакак органиммуннойсистемы. Педиатрия 2010;№2:10—18.
- Долгушин И. И., Бухарин О. В. Нейтрофилы и гомеостаз. Екатеринбург: УрО РАН, 2001.
- Кашутин С. Л., Добродеева Л. К. Содержание иммунокомпетентных клеток в коже у практически здоровых людей. Мед. иммунология 2000; 2(№ 2):128—129.
- Кохан М. М., Куклин И. А., Базарный В. В. Атопический дерматит и злокачественные лимфомы кожи. Аллергология и иммунология 2000; 1(№ 2):72.
- Ярилин А. А. Кожа и иммунная система. Косметика и медицина 2001; № 2:5—13.
- Aguilar A. Skin associated lympphoid tisues (SALT). Its normal and pathological function. An R Acad Nac Med 2006; 123:367—377.
- Albanesi C., Scarponi C., Sebastiani S., Cavani A. A cytokine-to-chemokine axis between T-lymphocytes and keratinocytes can favor Th1 cell accumulation in chronic inflammatory skin diseases. J Leukocyte Biol 2001; 70:617—623.
- Babina M., Guhl S., Stдrke A., Kirchhof L.Comparative cytokine profile of human skin mast cells from two compartments—strong resemblance with monocytes at baseline but induction of IL-5 by IL-4 priming. J Leukocyte Biol 2004; 75:244—252.
- Clark R. A., Chong B., Mirchandani N. The vast majority of CLA+ T cells are resident in normal skin. J Immunology 2006; 176:4431—4439.
- Fuhlbrigge R. C., Kieffer J. D., Armerding D., Kupper T. S. Cutaneous lymphocyte antigen is a specialized form of PSGL_1 expressed on skin-homing T cells. Nature 1997; 389: 978—981.
- Hudak S., Hagen M., Ying L., Daniel C.,Oldham E., McEvoy L. M., Bowman E. P. Immune surveillance and effector functions of CCR10+ skin homing T cells. J Immunol 2002; 169:1189—1196.
- Kagami S., Sugaya M., Minatani Y., Ohmatsu H.Elevated serum CTACK/CCL27 levels in CTCL. J Invest Dermatol 2006; 126:1189—1191.
- Kanitakis J. Immunohistochemistry of normal human skin. Eur J Dermatol 1998; 8:539—547.
- Lewis J. M., Girardi M., Roberts S. J., Barbee S. D., Hayday A. C. Selection of the cutaneous intraepithelial gammadelta+ T cell repertoire by a thymic stromal determinant. Nat Immunol 2006;8:843—850.
- Lipscomb M. F., Masten B. J. Dendritic cells: immune regulators in health and disease. Physiol Rev 2002; 82:97—130.
- Robert C., Kupper T. S. Inflammatory skin diseases, T cells, and immune surveillance. N Engl J Med 1999; 341:1817—1828.
- Schaerli P., Britschgi M., Keller M. Сharacterization of human T cells that regulate neutrophilic skin inflammation. J Immunol 2004; 173:2151—2158.
- Singer A. J., Clark R. Cutaneous wound healing. N Engl J Med 1999; 341:738—746.
- Streilein J. W. Skin_associated lymphoid tissue. Immunol Ser 1989; 46:73—96.
- Werner S., Grose R. Regulation of wound healing by growth factors and cytokines. Physiol Rev 2003; 83:835—870.