Чем чревато состояние гемоконцентрации?
Чем опасна гемоконцентрация (сгущение крови) при беременности? Пострадать от этой патологии может и мать и ее будущий малыш. Врач данную ситуацию сразу же ставит на контроль, поскольку могут иметь место следующие последствия:
- Варикоз вен,
- Появление тромбов,
- Инсульт,
- Инфаркт.
Для ребенка данная ситуация еще опаснее. Ему грозит:
- Кислородное голодание,
- Патологическое развитие,
- Замирание беременности,
- Угроза выкидыша,
- Преждевременные роды.
Риски для матери и ребенка
Основная опасность, таиться в образовании тромбов.
Часто, после родов у новоиспеченной мамочки, может развиться варикоз. Закупорка кровеносных сосудов, может отрицательно повлиять как на плод, который будет испытывать дефицит кислорода, так и на саму будущую маму. Из-за этого, может существенно возрасти возможность выкидыша или преждевременных родов, инфаркта или инсульта. На ранних сроках излишне густая кровь, может привести к замершей беременности. Поэтому, так важно вовремя посещать врача и полностью следовать его рекомендациям. Если же у вас появились сомнения по поводу назначенного лечения, незамедлительно консультируйтесь с несколькими врачами, так вы сможете исключить риск врачебной ошибки или халатного отношения.
Опасна ли густая кровь при беременности для женщины и плода?
Выявив изменение густоты крови у беременной, доктор оценивает степень этих нарушений и определяет тактику ведения пациентки.
Именно по результатам коагулограммы специалист сможет определить степень опасности сгущения крови при беременности. В некоторых случаях, при незначительных изменениях показателей, врач не придает серьезного значения густоте крови и дает женщине общие рекомендации относительно диеты и потребления жидкости, направленные на устранение этого симптома. В таких ситуациях не следует волноваться, т. к. такое сгущение крови не несет угрозы ни будущей матери, ни плоду, а после родов показатели коагулограммы стабилизируются самостоятельно.
Иногда причиной сгущения крови во время беременности становится прием железосодержащих препаратов, которые назначаются при снижении уровня гемоглобина. Такой симптом тоже не должен вызывать волнение у женщины, т. к. после устранения анемии и отмены этих лекарственных средств состояние крови стабилизируется.
При более серьезных изменениях в показателях коагулограммы врач может рекомендовать беременной пройти курс терапии для разжижения крови. В таких ситуациях женщине также не следует волноваться, а просто выполнять все назначения врача. Опасность такого сгущения крови кроется в повышении риска образования тромбов и затрудненном токе крови по сосудам, но эту ситуацию можно исправить.
Замедленный ток вязкой крови по сосудам и более интенсивная нагрузка на сердце вызывает недостаточное поступление кислорода и питательных веществ во все ткани и органы. Это приводит к появлению таких симптомов у беременной:
- постоянная вялость;
- ухудшение памяти;
- сонливость;
- сухость во рту;
- тяжесть в ногах;
- похолодание конечностей.
При малоподвижном образе жизни и отсутствии лечения повышенная склонность к тромбообразованию может приводить к развитию таких осложнений у будущей матери:
- тромбозы;
- тромбофлебит;
- ТЭЛА;
- варикозная болезнь;
- заболевания сердечно-сосудистой системы (инфаркт, гипертоническая болезнь, инсульт, атеросклероз).
Значительно повышенная густота крови негативно сказывается и на состоянии будущего малыша. В результате повышенного тромбобразования и замедленного тока крови со стороны плода могут наблюдаться такие нарушения:
- выкидыш или преждевременные роды;
- замершая беременность;
- гипоксия;
- задержка в развитии.
Именно в связи с вышеперечисленными возможными осложнениями густой крови женщинам, планирующим беременность, следует отказаться от зачатия до завершения курса терапии такого состояния. В ряде случаев это нарушение в свертывающей системе крови может быть опасным для жизни будущей матери и малыша, а во время вынашивания ребенка женщине можно принимать не все лекарственные препараты. Поэтому избавляться от этого симптома лучше до наступления беременности.
- Густая кровь что делать : как разжижить густую кровь
При планировании зачатия врач обязательно назначит проведение коагулограммы для исключения нарушений в свертывающей системе крови. Особенно актуально проведение такого исследования в определенных группах риска:
- в анамнезе женщины были случаи выкидышей или замерших беременностей;
- у женщины или ее родственников наблюдается варикозное расширение вен;
- у близких родственников женщины были тромбозы, инфаркты или инсульты;
- женщина профессионально занимается спортом, который связан с интенсивными физическими нагрузками.
Коагулограмма — что это за анализ?
Работа кровеносной системы — едва ли не самый главный показатель здоровья. Во время беременности она требует к себе повышенного внимания. Коагулограмма выявляет нарушения гемостаза — системы, которая отвечает в нашем организме за жидкое состояние крови в норме и за свертываемость крови для остановки кровотечений. Если показатели гемостаза понижены, у человека большие кровопотери даже из-за незначительного пореза. Слишком высокая (гиперкоагуляция) приводит к тромбозам, инфарктам и инсультам.
По мнению медиков, опасность и той и другой аномалии в том, что в повседневной жизни они могут никак себя не обнаруживать. Но во время операции или родов грозят развитием критической ситуации.
Система гемостаза при беременности претерпевает некоторые изменения. Поэтому коагулограмма до беременности и во время нее разная. Природой предусмотрена такая естественная перестройка. В процессе вынашивания ребенка в организме женщины возникает третий круг кровообращения, который называют маточно-плацентарным. Происходит подготовка к увеличению количества циркулирующей крови. Это важно в том числе и из-за неизбежной во время родов кровопотери.
Причины
Во время вынашивания малыша будущая мама сталкивается с проведением огромного количества анализов. Общий анализ крови и гемокоагулограмма – обязательные тесты, которые включены в рекомендуемый перечень лабораторных исследований, выполняемых во время беременности.
«Густая» кровь – это клиническое понятие, которое определяется в том случае, если в крови значительно повышено количество форменных элементов. Обычно к развитию этой ситуации при беременности приводят различные нарушения тромбообразования. Проявляться данные патологии могут как на ранних, так и на самых поздних сроках вынашивания малыша.
Нужно отметить, что в норме кровь довольно жидкая. Такая физиологическая особенность необходима для того, чтобы полноценно осуществлялась ее транспортная и питательная функция.
В крови растворено довольно много различных питательных веществ, а также кислород. Все эти элементы нужны плоду для его активного роста и развития.

К развитию патологических нарушений, связанных с образованием густой крови, приводит воздействие следующих причин:
- Индивидуальные особенности будущей мамы. Если у женщины присутствовали какие-либо гематологические нарушения еще до наступления беременности, то во время вынашивания малыша они будут значительно прогрессировать. Обычно такая ситуация встречается в семьях, где у нескольких членов есть различные заболевания сердечно-сосудистой системы. Наличие у близких родственников беременной женщины инфаркта или инсульта в анамнезе также является предрасполагающим фактором к повышенному тромбообразованию.
- Нарушение питьевого режима. Недостаточное поступление в организм будущей мамы воды может привести к тому, что ее кровь станет более густой. Такое нарушение довольно часто происходит, если женщина страдает токсикозом. Частая рвота способствует обезвоживанию, что приводит к выраженному сгущению крови.
- Недостаточное поступление необходимых витаминов и микроэлементов. Витаминный баланс очень важен во всех периодах беременности. Вынашивание малыша – очень энергетически затратное время. Для осуществления всех биологических реакций нужны ферменты, которые не могут образоваться в материнском организме без определенных витаминов и микроэлементов.
- Частое употребление сладостей и других «быстрых» углеводов. Большое количество поступающего в кровь сахара приводит к тому, что значительно изменяется ее вязкость. Если будущая мама в течение всей беременности кушает много сладостей и конфет, то это не только может способствовать повышенному тромбообразованию, но и даже приводит к развитию у нее признаков сахарного диабета.
- Перенасыщение организма железосодержащими препаратами. Эти средства обычно назначаются беременным женщинам, у которых во время вынашивания малыша было обнаружено снижение гемоглобина. Чрезмерное употребление железосодержащих препаратов может привести к повышению тромбоцитов в периферической крови.
- Нарушенная работа селезенки. Этот орган необходим организму для поддержания оптимальной концентрации форменных элементов крови. Гиперспленизм – это патологическое состояние, которое характеризуется значительными нарушениями в работе селезенки.
Данная патология, возникающая во время беременности, также способствует прогрессированию тромбообразования.
Важно отметить, что существует и ряд специфических патологий, которые возникают преимущественно только во время беременности. Так, к повышению вязкости крови и нарушению ее текучести может привести антифосфолипидный синдром. Врачи отмечают, что заболеваемость данной патологией с каждым годом только растет.
Сильная кровопотеря или травматический шок, возникший в результате какой-то травмы, могут также способствовать тому, что изменятся базовые показатели крови. Проявиться данные патологии могут также в том случае, если у беременной женщины появились признаки внутреннего кровотечения. Это состояние является уже крайне неблагоприятным и требует срочного оказания медицинской помощи.
- Болят суставы пальцев рук при беременности: причины боли в кистях
Рассчитать срок беременности
Физиология системы гемостаза и ее особенности при неосложненной беременности
Систему гемостаза, или систему регуляции агрегатного состояния крови (РАСК), О.К. Гаврилов (1) определил как «комплекс избирательно вовлеченных компонентов, у которых взаимодействие и взаимоотношения, несмотря на их противоположный характер, принимают вид взаимодействия в получении фокусированного полезного результата – гемостатического потенциала крови, обеспечивающего сохранение жидкого состояния или свертывание крови».
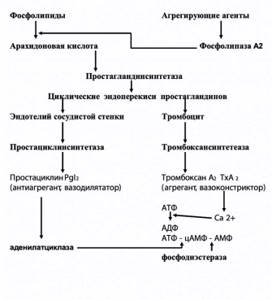
Рисунок 1. Сосудисто-тромбоцитарное звено гемостаза
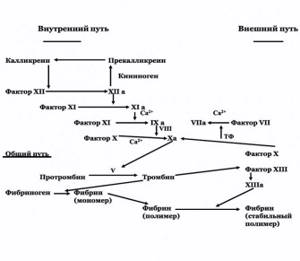
Рисунок 2. Прокоагулянтное звено гемостаза. Внешний путь свертывания крови
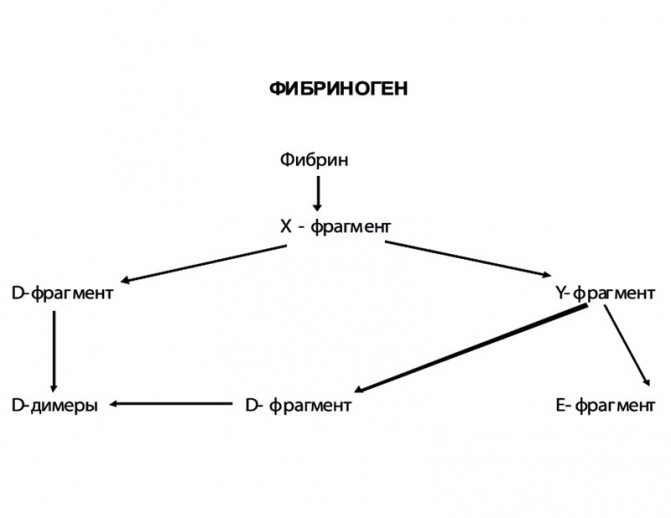
Рисунок 3. Пути фибринолиза
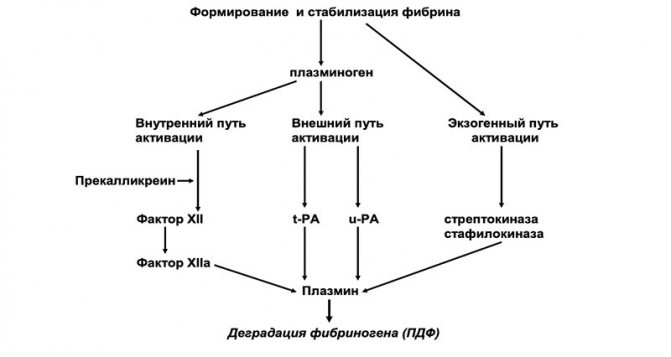
Рисунок 4. Образование ПДФ
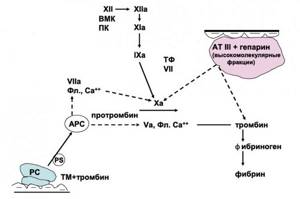
Рисунок 5. Система протеина С

Система РАСК мозаична, то есть гемостатический потенциал в различных участках кровотока, в различных органах неодинаков. Это является нормальным состоянием функциональной системы РАСК. Одна из основных особенностей системы РАСК – взаимодействие коагуляционных протеинов с поверхностями мембран и с ионами металлов. Велика роль фосфолипидов, в первую очередь фосфатидилсерина.
Вторая особенность – быстродействие системы с привлечением механизмов положительной и отрицательной обратной связи. Высокая быстрота ответа и скорость реакций осуществляются за счет базального уровня циркулирующих коагуляционных энзимов.
Третьей особенностью является ограниченность ответной реакции в отношения локализации и длительности воздействия, что имеет большое значение.
Четвертая особенность заключается в высокой интегрированности системы РАСК с другими защитными системами крови, в том числе с системой комплемента и системой цитокинов (интерлейкин 1-β, фактор некроза опухолей-α) (2).
Схематично система гемостаза представлена следующими компонентами:
- сосудистым комплексом (в первую очередь эндотелием) и тромбоцитарным звеном;
- звеном прокоагулянтов;
- фибринолитическим звеном;
- звеном ингибиторов свертывания крови.
Наиболее важное значение среди элементов сосудистой стенки имеет эндотелий. Антитромботическая активность эндотелия обусловлена синтезом простациклина (РGI2) – мощного ингибитора агрегации тромбоцитов, оксида азота (NО), тканевого активатора плазминогена (t-РА), антитромбина III (АТ III), ингибитора внешнего пути свертывания крови (ТFPI), тромбомодулина.
По данным З.С. Баркагана (3), помимо этих функций эндотелия имеется еще ряд особенностей: неспособность к контактной активации системы свертывания крови; создание антикоагулянтного потенциала на границе кровь/ткань путем фиксации на эндотелии комплекса гепарин-антитромбин III, способность удалять из кровотока активированные факторы свертывания.
Участие тромбоцитов в гемостазе определяется их способностью к адгезии у места повреждения эндотелия, процессом их агрегации и образования первичной тромбоцитарной пробки, их способностью поддерживать спазм сосудов путем секреции вазоактивных веществ – адреналина, норадреналина, серотонина, АДФ и др., а также образовывать, накапливать и секретировать вещества, стимулирующие адгезию и агрегацию.
Адгезия (прилипание) тромбоцитов к участку повреждения сосудистой стенки – процесс обратимый. Агрегация тромбоцитов протекает одновременно с адгезией.
В значительной степени механизм агрегации тромбоцитов стал понятен после открытия простагландинов в тромбоцитах и сосудистой стенке. Выяснилось, что различные агрегирующие агенты активируют фосфолипазу А2, которая вызывает отщепление фосфолипидов от арахидоновой кислоты – мощного агрегирующего вещества (рисунок 1). Под влиянием простагландинсинтетазы образуются циклические эндоперикиси простагландинов I2 и Н2, стимулирующие сокращение микрофибрилл тромбоцитов и оказывающие агрегирующее действие. Под влиянием тромбоксансинтетазы в тромбоцитах синтезируется тромбоксан А2. Последний способствует транспорту Са2+ в тромбоците, что приводит к образованию АДФ – основного эндогенного стимулятора агрегации. Уровень Са2+, а также уровень цАМФ – универсального биологического переносчика – регулируется аденилатциклазой, катализирующей реакцию АТФ – цАМФ.
В эндотелии под влиянием простагландинсинтетазы арахидоновая кислота превращается в эндоперекиси простагландинов (аналогично этим процессам в тромбоцитах). Далее под влиянием простациклинсинтетазы образуется простациклин (простагландин I2), который обладает мощным дезагрегирующим действием и, кроме того, активизирует аденилатциклазу (4).
Таким образом, формируется т.н. тромбоксан-простациклиновый баланс – один из основных регуляторов состояния тонуса сосудистой стенки и агрегации тромбоцитов.
По функциональным и структурным свойствам факторы свертывания крови можно подразделить на:
1. Сывороточные энзимы:
- витамин К-зависимые: II, VII, IХ, Х;
- факторы системы контакта: ХI, ХII, прекалликреин;
2. Трансамидазы: ХIII. 3. Система кофакторов свертывания:
- плазменные: V, VIII, высокомолекулярный кининоген (ВМК), фибриноген;
- тканевые: т.н. тканевой фактор (ТФ).
Условно различают внешний и внутренний механизмы активации свертывания крови (рисунок 2).
Процесс свертывания крови можно условно разделить на 3 стадии:
Комплекс последовательных реакций, приводящий к образованию протромбиназы, или протромбинактиваторного комплекса, в состав которого входят: фактор Ха, III фактор тромбоцитов (фосфолипид), Vа и VIIIа факторы и ионы Са2+. Это наиболее сложная и длительная фаза.
Под влиянием протромбиназы происходит переход протромбина в тромбин.
Под влиянием тромбина фибриноген переходит в фибрин. Затем наступает стабилизация фибрина.
Основным компонентом внешнего пути свертывания является тканевой фактор (ТФ). ТФ является протеином внутренней мембраны, синтезируется макрофагами и эндотелиальными клетками. Синтез ТФ индуцируют эндотоксины и ряд цитокинов. Важное значение в активации ТФ придается фосфолипидам, в первую очередь, фосфотидилсерину. ТФ выполняет функцию кофактора VII фактора свертывания крови. Активированный VIIа фактор, в свою очередь, переводит в деятельное состояние фактор Х. Внешний путь свертывания крови осуществляется значительно быстрее, чем внутренний, в связи с чем, его можно рассматривать в качестве «скоропомощного» варианта коагуляции (5).
Внутренний путь свертывания крови начинается с активации ХII фактора.
ХIа фактор превращает IХ фактор в IХа в присутствии ионов Са2+. Активация Х фактора катализируется Са2+-зависимым мембранным комплексом, состоящим из факторов IХа, Vа и VIIIа (внутренний путь) и/или факторов VIIа и ТФ (внешний путь).
Vа и VIIIа факторы являются коферментами активации ХI фактора.
После образования протромбинактиваторного комплекса начинается второй этап гемокоагуляции – переход протромбина (II фактора) в свою активную форму – тромбин. Интересно отметить, что протромбин, помимо коагулянтной функции, участвует в дифференцировке нервных клеток. Переход протромбина в тромбин происходит в 2 этапа: образование мезотромбина и образование фрагментов F1+2 протромбина. Последний используется для диагностики гиперкоагуляционных состояний. Тромбин является конечным продуктом второй стадии гемокоагуляции, кроме того, вызывает активацию кофакторов и тромбоцитов. Тромбин принимает активное участие в репаративных процессах поврежденных тканей.
Образование фибрина и его стабилизация представляют собой третий, финальный, этап формирования тромба. Этот процесс включает 3 фазы:
- отщепление от фибриногена (фактор I) фибринопептидов под влиянием тромбина;
- полимеризация фибрина;
- стабилизация фибрина под влиянием ХIIIа фактора (фибринстабилизирующий фактор).
В первой фазе под влиянием тромбина происходит расщепление фибриногена на фибринопептиды А и В. В дальнейшем образуются растворимые комплексы мономеров фибрина (РКМФ). Эти субстанции используются на практике в качестве теста, определяющего степень активности фибринообразования. Параллельно происходит полимеризация фибрина и далее – стабилизация фибрина с участием ХIIIа фактора. Важно отметить, что ХIII фактор играет большую роль в качестве матрикса, обеспечивающего рост и пролиферацию трофобласта и плаценты.
Фибринолитическая система является неотъемлемой частью системы гемостаза ибо всегда сопутствует свертыванию крови и даже активируется теми же факторами, что и процесс гемокоагуляции.
В процесс фибринолиза принимают участие элементы плазмы, тромбоциты и другие клетки. Основным ферментом, разрушающим фибрин, является плазмин, который в процессе активации образуется из неактивного плазминогена (рисунок 3). Процесс активации плазминогена включает 3 пути:
- внутренний;
- внешний;
- экзогенный.
Основным является внешний путь, однако и внутренний, и экзогенный пути играют важную роль. На внутренний путь фибринолиза приходится около 15% всей фибринолитической активности. Активация плазминогена по внутреннему пути происходит при участии ХII фактора, прекалликреина, высокомолекулярного кининогена (ВМК) и ХI фактора.
Внешний путь активации плазминогена происходит при участии двух основных активаторов: тканевого (t-РА) и урокиназного (u-РА) типов.
Экзогенный путь активации фибринолиза ассоциируется с бактериальными белками, в частности стрептокиназой и стафилокиназой. На первом этапе фибринолиза происходит отцепление Х-фрагмента, который затем расщепляется на Y- и D-фрагменты. Х- и Y-фрагменты получили название «ранних», или высокомолекулярных, продуктов деградации фибрина и фибриногена (ПДФ). Y-фрагмент в дальнейшем разрушается на Е-фрагмент и еще один D-фрагмент. D- и Е-фрагменты являются «поздними», или низкомолекулярными, ПДФ (рисунок 4). В результате полной деградации фибринового сгустка образуются D-димеры (D-D).
ПДФ обладают выраженным антикоагулянтным действием. Они не только блокируют фибрин, но и препятствуют образованию протромбина и полимеризации фибрин-мономеров, снижают или подавляют адгезивную и агрегационную функцию тромбоцитов. Определение характера и содержания ПДФ имеет значение в оценке форм синдрома ДВС, поскольку определяет масштабы внутрисосудистого свертывания. Важно отметить, что ПДФ значительно подавляют сократительную активность матки (1).
Естественные антикоагулянты можно разделить на первичные и вторичные. Первичные находятся в плазме и форменных элементах крови и действуют независимо от того, происходит образование или растворение кровяного сгустка. Вторичные антикоагулянты возникают в процессе свертывания крови и фибринолиза благодаря протеолитическому действию фермента на субстрат.
Антитромбин III (АТ III) является основным физиологическим ингибитором коагуляционных факторов, способен блокировать протромбиназу как по внешнему, так и по внутреннему механизму, включая факторы ХIIа, ХIа, VIIIа, IХа, Ха, тромбин и калликреин. АТ III синтезируется в печени и эндотелии микроциркуляторного русла. Гепарин повышает степень ингибиции АТ III-факторов свертывания в несколько тысяч раз. Помимо АТ III, ингибирующими свойствами по отношению исключительно к тромбину обладает кофактор гепарина II (НС II).
Мощным физиологическим антикоагулянтом является ингибитор внешнего пути свертывания (ТFPI), или липопротеин-ассоциированный ингибитор коагуляции (LACI). ТFPI в основном синтезируется в эндотелии микроваскулярного русла, в меньшей степени мегакариоцитами и фибробластами. ТFPI является кофактором низкомолекулярного гепарина (НМГ). НМГ способен повышать уровень ТFPI в крови на 500%. ТFPI является важнейшим ингибитором комплекса VIIа – тканевой фактор (VIIа – ТФ). Кроме того, ТFРI ингибирует Ха-фактор и в меньшей степени – IХа–фактор.
Другими ингибиторами гемокоагуляции являются С1-ингибитор эстеразы, α2-макроглобулин, α1-антитрипсин.
Протеин С (РС) синтезируется в печени совместно с протеином S (РS) и тромбомодулином (ТМ), является важным регулятором коагуляционного каскада, функционирующего по принципу отрицательной обратной связи (рисунок 5). Для осуществления антикоагулянтной функции РС необходима его активация, приводящая к образованию активированного протеина С (АРС). Этот процесс осуществляется с участием Ха-фактора, тромбина, тромбомодулина (ТМ). Основное значение АРС заключается в инактивации V, Vа и VIIа факторов, что препятствует генерации протромбинактиваторного комплекса. Эти реакции усиливаются в присутствии ионов Са2+, анионных мембран и протеина S (РS) (6).
АРС также усиливает фибринолиз, что связано с его способностью нейтрализовать ингибитор активатора плазминогена (РАI-1). Противовоспалительное действие АРС связано с ингибированием продукции провоспалительных цитокинов, АРС ингибируется РАI-1, α1-антиплазмином, α2-макроглобулином.
Тромбомодулин (ТМ) локализуется на поверхности эндотелия, выполняет антикоагулянтную функцию и обеспечивает тромборезистентность сосудистой стенки. ТМ позитивно влияет на процессы внутриутробного развития плода. В процессе деградации ТМ в кровотоке появляется растворимый ТМ, расцениваемый как маркер повреждения эндотелия и ранний доклинический признак преэклампсии.
Помимо первичных естественных антикоагулянтов в процессе свертывания крови образуются вторичные антикоагулянты. К ним относятся ПДФ, «отработанные», т.е. прошедшие фазы активации, факторы свертывания крови.
Патологические антикоагулянты отсутствуют в крови в нормальных условиях, но появляются при различных иммунных нарушениях. К ним относятся антитела к факторам свертывания крови, чаще всего к факторам VIII и V (нередко возникающие после родов и массивных гемотрансфузий), и иммунные комплексы – волчаночный антикоагулянт.
Таким образом, система регуляции агрегатного состояния крови (РАСК) подчинена законам положительной и отрицательной обратной связи, когда практически каждый компонент этой системы, выполнив свою первоначальную функцию, переходит в состояние, обеспечивающее противоположные эффекты. В то же время, по мнению Б. И. Кузника (7), эта система «настроена таким образом, чтобы обеспечить свертывание крови, ибо нет такого состояния, при котором организму было бы необходимо кровотечение».
В настоящее время доминирует точка зрения, согласно которой в организме беременной женщины создаются определенные условия для развития синдрома диссеминированного внутрисосудистого свертывания. Это выражается в повышении общего коагулянтного потенциала (суммарная активность факторов свертывания), повышении функциональной активности тромбоцитов при некотором снижении их количества, в снижении фибринолитической активности при увеличении ПДФ, снижении активности АТ III при некотором уменьшении его содержания. Эти особенности носят компенсаторно-приспособительный характер и необходимы как для нормального формирования фето-плацентарного комплекса, так и для ограничения кровопотери в родах.
В активации системы гемостаза большую роль играют изменения общей гемодинамики в организме беременной женщины. Для нормального функционирования фето-плацентарной системы в условиях высокого коагуляционного потенциала крови вступают в действие компенсаторно-приспособительные механизмы: увеличение количества терминальных ворсин малого калибра с гиперплазией и периферическим расположением капилляров, уменьшение толщины плацентарного барьера с истончением синцития, образование синцитиокапиллярных мембран, синцитиальных узелков.
Особенности функционирования системы гемостаза связаны с определенными изменениями в системе спиральных артерий матки, это инвазия клеток трофобласта в стенку спиральных артерий, замещение внутренней эластичной мембраны и внутренней медии толстым слоем фибрина, нарушение целостности эндотелия и обнажение коллагеновых субэндотелиальных структур. В этом процессе имеет значение и развертывание межворсинчатого пространства с присущими ему морфологическими и гемодинамическими особенностями (8).
При физиологически протекающей беременности изменения в системе гемостаза идут пропорционально сроку гестации. Эти изменения являются физиологической адаптацией и имеют 2 основные функции – поддержание нормального функционирования фето-плацентарного комплекса и остановка кровотечения из плацентарной площадки после отделения плаценты.
Уровень тромбоцитов при неосложненном течении беременности остается практически неизмененным. При беременности наблюдается возрастание всех факторов свертывания, за исключением факторов ХI и ХIII. Увеличение уровня фибриногена начинается с 3-го месяца беременности. Важно отметить, что содержание фибриногена в периферической крови выше, чем в маточно-плацентарном кровотоке.
Коагуляционный потенциал крови возрастает также в связи с тем, что снижается уровень антитромбина III. Протеин С повышается в основном в послеродовом периоде, а протеин S снижен при беременности и значительно снижен после родов.
Отмечено снижение фибринолиза в конце беременности и в процессе родов, происходит повышение концентрации РКМФ с 8 недель беременности параллельно с повышением содержания фибриногена. Уровень некоторых фрагментов продуктов деградации фибрина повышается с 16 недель беременности и достигает плато в 36–40 недель.
Уровень плазминогена повышается во время беременности. Тканевой активатор плазминогена (t-РА) нейтрализуется ингибиторами активации плазминогена. При беременности ведущее значение имеет плацентарный тип ингибитора (РАI-2), уровень которого увеличивается к концу беременности в 25 раз. Концентрация эндотелиального ингибитора (РАI-1) увеличивается с 25 недель беременности. Полагают, что РАI-2 играет роль в процессах инвазии, а также имеет функцию защиты от преждевременной отслойки плаценты (9).
Диагностические исследования для определения вязкости крови
Часто слишком густая кровь при беременности выявляется при плановой сдаче анализов. При заборе крови из пальца она слишком быстро сворачивается, закупоривает трубки, плохо вытекает и т.д.
Однако одного визуального анализа мало для правильной диагностики и выявления причин патологии. Для данных целей предназначена коагулограмма. Этот диагностический метод помогает выяснить, имеются ли проблемы со свертываемостью крови, и помогает разработать правильную тактику терапии. Обследование проводится только на голодный желудок.
Для постановки диагноза важны следующие показатели:
- Индекс протромбина. Он показывает скорость свертываемости крови в процентном соотношении. Оптимальными являются показатели 110% с отклонениями в 32%. Если показания пациентки выше, кровь слишком густая.
- Содержание фибриногена. В первом триместре его количество должно составлять от 2 до 4 г/л, в третьем – около 6.
- Тромбиновое время – скорость образования кровяного сгустка. В норме он образовывается за 15 с. Для беременных показатель слега повышен – до 25 с.
- Волчаночный коагулянт – склонность женщины к волчанке.
- Активированное частичное тромбопластиновое время. В норме оно составляет от 25 до 35 с, для беременных – от 17 до 20 с.

Терапия нарушений свертываемости крови при беременности.
Нарушения свертывания даже сегодня относятся к не поддающимся подсчету и наиболее опасным осложнениям беременности. Условием эффективного лечения является знание представление о физиологических изменениях гемостаза при беременности. Чаще всего встречаются острые приобретенные нарушения гемостаза, такие как коагулопатии потери и потребления, связанные со значительной потерей крови и неадекватным замещением объема (например, при постпартальной атонии) и с диссеминированным внутрисосудистым свертыванием (PIG) индуцированным различными акушерскими патологиями. В 10% всех беременностей надо рассчитывать на тромбоцитопенические кровотечения различного генеза. Болезнь von Willebrand — это наиболее частый врожденный кровоточивый диатез, который, как и очень редкие наследственные коагулопатии (например, гемофилия А и В), требует дифференцированного анализа свертываемости и междисциплинарного подхода со специфической терапией замещения intra и postpartum.
Нормальные изменения свертывания при беременности
Нормальная беременность характеризуется состоянием гиперкоагуляции, прежде всего связанной с прогрессивным увеличением факторов: VII (почти на 80%), VIII (на 10%), X (на 80%) и фибриногена (почти на 70%) приблизительно с 20 недели беременности. Протромбин (фактор II), фактор V и фактор IX не дают никаких или проявляют весьма незначительные повышения концентрации при беременности, тогда как фактор XIII до окончания срока снижается приблизительно на 50% от нормального значения. Следст-вием этого в 3 триместре оказываются существенные удлинения протромбинового и тромбинового вре-мени при общем неизмененном aPTT.
Клиническое значение имеет тот факт, что из-за индуцированной беременностью увеличения выработки специальных факторов свертывания (например, фактор VIII) слабые формы врожденных коагулопатий клинически могут оставаться незамеченными. Ингибиторы свертывания во время беременности ведут себя по-разному: антитромбин III в основном не меняется с легким понижением вплоть до конца беременности, как впрочем и протеин С, и наоборот, активность общего протеина S дает существенное снижение. Кроме того, при беременности отмечается уменьшение фибринолитической активности (например, увеличение ингибитора плазминоген-активатора).
Повышенную агреггабельность тромбоцитов на поздних сроках беременности следует скорее рассматривать как способствующий тромбозу фактор, при чем количество тромбоцитов и время выживаемости тромбоцитов при физиологической беременности в общем остается неизменным. Детальные обзоры по теме можно найти также (16,18).
В общем при нормально беременности имеется Low-grade активирование свертываемости, распознаваемого среди прочего по возрастанию концентрации D-димеров (терминальные продукт лизирования сет-чатого фибрина), которое функционально компенсируется индуцированной беременностью гемодилюцией с увеличением капиллярной перфузии и микроциркуляции.
| Таблица 1 | |||
| Критические пограничные значения при острых осложнениях кровотечения | |||
| Параметр | Пограничное значение | ||
| Гемоглобин | <8,5 g/l при персистирующем кровотечении | ||
| Количество тромбоцитов | 50.000/mg | ||
| Quick-значение | <40% | ||
| aPTT | >1,5 кратное увеличение от значение нормы | ||
| Фибриноген | <100 mg/dl | ||
| Таблица 2 | |||
| Терапия коагулопатии разведения | |||
| Устранение причины кровотечения (хирургически или медикаментзно) | |||
| При потере до 20% объема крови (1,2 l): кристаллический/коллоидный раствор i.v. (например HAES) | |||
| При потере > 20 (-30)% объема крови Эритроцитарный концентрат Замороженная плазма (FFP) | 2(-3) 1 | ||
| В неотложном случае: эритроцитарный концентрат FFP | 0 Rhesus negativ AB группа крови | ||
| При отсутствии FFP: концентрат фибриногена концентрат антитромбина-III | 50 mg/kg веса тела 25 IE/kg веса тела | ||
| Тромбоциты <30.000 (50.000)/ml: тромбоцитарный концентрат | |||
| Таблица 3 | |||
| Лечение тяжелых терапирефрактерных нарушений гемостаза рекомбинантным активированным фактором VII (Novo Seven) | |||
| Механизм действия | Выделение и связывание «тканевого фактора» с фактором VIIa ® фактор VIIa активирует на поверхности активированных тромбоцитов непосредственно фактор Х ® массивное образование тромбина («Trombin-Burst») ® образование стабильного фибринового сгустка | ||
| Наблюдение | Никакой специальной диагностики, клинический эффект (кровотечение) | ||
| Дозировка | 90 mg kg веса тела, повтор через 15 минут | ||
| Применяется как Ultima ratio — эффективность в описаниях случаев. Разрешения не имеет. | |||
Остро приобретенные нарушения гемостаза
Коагулопатии потери и потребления
Общим конечным этапом нелеченных перипартальных кровотечений различного генеза оказывается коагулопатия потери или разведения и/или коагулопатия потребления. При беременности в связи с возрастанием циркулирующего объема крови в среднем в 1,5-1,7 раза развивается «протективная гиперволемия», которая в совокупности с быстрой постпартальной мобилизацией значительного объема венозной крови, а также через устранение Vena-cava-inferior компрессии после родов в начале может компенсировать различную и индивидуально высокую потерю крови. Основное правило гласит, что объем крови беременной составляет 8,5-9% от ее веса тела.
При потерях >20% (1,2-1,5 l) циркулирующей крови демпферных возможностей оказывается недостаточно. Необходимые инициальные введения объема, хотя и могут воспрепятствовать развитию шока с централизацией, тем не менее, они приводят к сильному разведению потенциала гемостаза, которого оказывается недостаточно для эффективного гемостаза (коагулопатия потери или разведения). Критические пограничные значения при острых осложнениях кровотечения в отношении манифестной коагулопатии представлены на таблице 1.
Основными причинами этой коагулопатии потери являются:
- постпартальная атония матки (75-82% всех постпартальных осложнений кровотечения),
- тяжелые акушерские повреждения,
- нарушения отслойки плаценты,
- преждевременная отслойка плаценты (часто комбинация диссеминированного внутрисосудистого свертывания/коагулопатии потери).
К редким причинам относятся кровотечение при аборте и при разрыве внематочной беременности и кровотечение при Plazenta-praevia. В отношении неотложного акушерского подхода в этих ситуациях подробно описано в недавно вышедших обзорах (16,17).
Терапия
Параметрами определяющими терапевтический подход являются сила кровотечения (фактически кровопотеря), клиническое состояние беременной и результаты картины крови и анализа свертываемости (таблица 1). Вместе с быстрым устранением причины кровотечения (медикаментозно, хирургически) при изначальной потери крови до 20% объема крови чаще всего бывает достаточным быстрое замещение объе-ма: 1 ml потери крови на 3 ml кристаллического раствора. Потери крови превышающие 20-30% объема крови требуют быстрого введения эритроцитарных концентратов и свежезамороженной плазмы («fresh frozen plasma»), которая содержит все протеины свертывания, включая антитромбин III в физиологическом сочетании: изначально в соотношении 2:1 или 3:1 (таблица 2).
При персистирующиех кровотечениях значение гемоглобина 8,5 mg/dl является терапевтически указующим для начала замещения эритроцитарными концентратами. Если профилактическая замещающая терапия не проводилась и на основании раннего определения глобальной свертываемости определяется имеющее значение для гемостаза снижение потенциала свертываемости (<100 mg/dl), то незамедлительно проводится введение соответствующей по группе крови свеже замороженной плазмы.
Если при сильном и сохраняющемся кровотечении отсутствует необходимая замороженная плазма (сначала ее следует оттаять) или, несмотря на введение FFP, происходит недопустимое снижение погранич-ных значений (таблица 1), то рекомендуется проводить замещение концентратами факторов свертываемости (табл. 2): например, при уровне фибриногена < 100 mg/dl проводится замещение фибриногеном в дозе 30-50 mg/kg веса тела. По возможности удерживать уровень фибриногена > 100 mg/dl (Cave: опасность тромбоза при значительном замещении!).
Новым многообещающим и, в отдельных случаях жизнеспасительным методом лечения, является внутривенное введение рекомбинантного активированного фактора VII (Novo Seven®): дозировка 60-90 g/kg веса тала, при необходимости повторение через 10-15 минут (таблица 3). При этом начинается процесс свертывания через высвобождение и связывание «tissue factor» (тканевого фактора) c активированным фактором VII. Фактор VIIa активирует на поверхности активированных тромбоцитов непосредственно фактор Х и вызывает таким образом массивное образование тромбина, так называемый «Trombin-burst», который быстро приводит к формированию стабильного фибринового сгустка.
Лабораторно-химический контроль за этой терапией не требуется, указателем служит снижение силы кровотечения. Рекомбинированный активированный фактор VII пока что разрешен только для лечения Hemmkorper-гемофилий , однако в будущем — не в последнюю очередь благодаря многим описаниям успешных случаев (см. обзор) — несомненно займет, по крайней мере в качестве Ultima ratio для хирургических вмешательств, прочное место в лечении жизнеугрожающих акушерских осложнений кровотечения (нарушения свертываемости).
Не бесспорно оптимальное время введения тромбоцитарного концентрата. Даже, если при тромбоцитопении < 20.000/l приходиться рассчитывать на возникновение спонтанного кровотечения, то мы принимаем решение о введении тромбоцитарного концентрата, прежде всего перед оперативной ревизией вследствие последующих кровотечений, (например, после Sectio caesarea) уже при падении количества тромбоцитов <50.000/l. После консолидации ситуации со свертыванием (фибриноген > 200 mg/dl), количество тромбоцитов >100.000/l рекомендуется после тяжелых перипартальых осложнений кровотечения провести медикаментозную профилактику тромбоза предпочтительно низкомолекулярным герином.
Диссеминированное внутрисосудистое свертывание и коагулопатия потребеления
Это системное тромбогеморрагическое осложнение характеризуется следующими клиническими фазами:
- активация системы свертывания (гиперкоагуляция),
- диссеминированное внутрисосудистое свертывание с потреблением факторов и ингибиторов свертывания, включая реактивный гиперфибринолиз,
- развитие коагулопатии потребления с кровотечение и/или микро-/макротромбозированием,
- отказ органа с диффузными кровоизлияниями.
Акушерские патологии приводящие к диссеминированному внутрисосудистому свертыванию (DIG) представлены на таблице 4, патофизиология и диагноз подробно описаны в другом месте (16). Клиническое значение имеет тот факт, что стадия активирования внутрисосудистого свертывания (распознаваемая по резкому скачку D-димеров) может перейти через клинически еще не отмечаемую и часто не определяемую глобальными параметрами свертывания фазу внутрисосудистого образования фибрина постепенно и незаметно в течение нескольких часов в клинически явную коагулопатию, из-за чего при соответствующем подозрении необходимо проводить текущий лабораторно-химический контроль сначала через 1-2 часа. Диагностика DIG представлена на таблице 5.
Терапия
Условием успешного лечения являются правильная постановка диагноза и устранение в основе лежащей патологии, обычно путем незамедлительного окончания беременности (иногда Sectio caesarea) например, при тяжелой преждевременной отслойке и/или молниеносном HELLP-синдроме.
Наряду с балансированным возмещением объема для поддержания адекватной микроциркуляции определяющим является своевременное введение эритроцитарных концентратов и свежезамороженной плазмы (табл.6).
| Таблица 4 | ||
| Причины диссеминированного внутрисосудистого свертывания и коагулопатии потребления | ||
| Преждевременная отслойка плаценты | ||
| Эмболия околоплодными водами | ||
| Септические состояния (хориоамнионит, пуерперальный сепсис) | ||
| Тяжелые гипертензивные осложнения беременности (преэклампсия, эклампсия, HELLP-синдром) | ||
| Внутриутробная гибель плода (Dead-fetus-Syndrome) | ||
| Обширная травматизация тканей | ||
| Таблица 5 | ||
| Диагностические критерии диссеминированного внутрисосудистого свертывания (по 15) | ||
| Параметр | Критическое значение | Тенденция без лечения |
| Тромбоциты | <100.000/ml | Понижение |
| Quick-показатель | <50% | Понижение |
| aPTT | >1,5 кратно | Увеличение |
| Фибриноген | <100 mg/dl | Понижение |
| Антитромбин | <50% | Понижение |
| D-димеры | >600 ng/dl | Увеличение |
При этом введение FFP лежит в основе терапии: по собственному опыту и в соответствие с руководством Bundesarztekammer (2001) в этой ситуации благодаря своевременному введению, по меньшей мере 2 единиц замороженной плазмы, удается избежать коагулопатии и прежде всего тогда, когда при проведении Sectio caesarea уже появились признаки сниженной способности свертывания крови. При этом следует учитывать, что в этот момент параметры общего свертывания изменены незначительно или пребывают в границах нормы или еще не проанализированы. В отдельных случаях должны быть выровнены не поддающиеся коррекции замороженной плазмой дефициты антитромбина (табл. 6).
При применении PPSB-препаратов (содержат витамин-К-активированные факторы свертывания II, VII, IX, X а также протеины C и S) следует соблюдать осторожность, так как эти препараты могут содержать различные по силе количества уже активированных факторов свертывания с последующим риском развития тяжелых тромбоэмболических осложнений. Поэтому перед применением необходимо введение антитромбина. В отношении введения тромбоцитарных концентратов применяются те же величины (масштабы), что и при коагулопатии потери.
Все еще продолжается обсуждение применения гепарина в связи с DIG и акушерскими осложнениями (в основном DIG-синдром). Совсем недавно снова появились сообщения о тяжелых постпартальных ослож-нений кровотечения при применении гепарина при постпартальном HELLP-синдроме. Не вдаваясь в детали этого обсуждения (см. обзор 16) следует обратить особое внимание на то, что гепарин (даже в низких дозировках), до тех пор пока не прекратилось кровотечение или существует повышенная опасность кровотечения, ни в коем разе не должен применяться в терапии острых акушерских коагулопатий потребления. Это касается особенно HELLP-синдрома, тяжелой преэклампсии и преждевременной отслойки плаценты! Гепарин не применяется в терапии острых акушерских каогулопатий потребления.
Чрезвычайно редко чрезмерный фибринолиз и фибриногенолиз могут вызывать тяжелое постпартальное нарушение свертывания (например, после эмболии околоплодными водами, частота которого составляет 1:6000-80.000 всех родов). В этих случаях при персистенции кровотечения, несмотря на вышеназванные мероприятия, после или во время лечения замещения показано применение антифибринолитиков: например, поливалентный ингибитор протеиназы Aprotinin (Trasylol) в начальное дозировке 500.000 KIE (Kallikrein-Inhibitor-Einheiten) внутривенно, с последующей дозой 200.000 KIE через 4-6 часов или до прекращения кровотечения. Также в случаях тяжелой терапи-рефрактерной коагулопатии потребления вследствие акушерской патологии снова появились описания успешного применения рекомбинантного активированного фактора VII, так что всегда следует помнить об этой Ultima-ratio-опции.
| Таблица 6 |
| Терапия острого нарушения гемостаза |
| Возмещение объема (ZVD, мочеток, гемоглобин, гематокрит) ® поддержание микроциркуляции ® коррекция метаболического ацидоза |
| Свеже замороженная плазма (FFP) и эритроцитарные концентраты По обстоятельствам 2 FFP «профилактически» |
| Персистирующее кровотечение (FFP недостаточно или отсутствует) Антитромбин-III-концентрат: 25 I.E. kg веса тела Значение Quick <40%: PPSB-препарат (25 I.E. kg веса тела) Фибриноген <100 mg/dl: концентрат фибриногена (50 mg/kg веса тела) |
| При чрезмерном фибринолизе и жизнеугрожающем кровотечении post partum Aprotinin (например. Trasylol) |
| Никакого гепарина пока продолжается кровотечение или имеется повышенная опасность кровотечения ! |
Хронические приобретенные нарушения гемостаза
К ним относятся прежде всего тромбоцитарные геморрагические диатезы:
- аутоиммуннотромбоцитопения (ATP, ITP),
- тромботическая-тромбоцитопеническая пурпура (TTP),
- вызванные медикаментами тромбоцитопатии (обзор 18).
Вызванное гемодилюцией и/или распадом тромбоцитов в 4-8% беременностей развивается так называемая «гестационная тромбоцитопения». Клинически определяющими являются количество тромбоцитов <70.000/l без дополнительной склонности к кровотечению, даже во время родов. Однако, у этих беременных с гестационной тромбоцитопенией имеется в 7,4 раза более высокий риск развития HELLP-синдрома при дальнейших беременностях.
Аутоиммуная тромбоцитопения
Идиопатическая тромбоцитопеническая пурпура (ITP) определяется как изолированная тромбоцитопения без клинически явных сопутствующих заболеваний или других причин снижения числа тромбоцитов (например, красная волчанка, HIV, медикаменты) и является наиболее частым основанием тромбоцитопении в 1 и 2 триместрах. Клинически на передний план выходят петехиальные кровоизлияния на коже и слизистых. Обзор диагностики можно найти в обзоре (1). Имеется несколько повышенный риск постпартальных осложнений кровотечения, следует обращать внимание на оптимальную хирургическую остановку кровотечения при акушерских ранениях.
Терапия
Терапия зависит от концентрации тромбоцитов. Количество тромбоцитов >30.000/l без кровотечений в общем не требует никакой терапии. Однако по условиям профилактики кровотечений количество тромбоцитов при родах и при применении региональной анестезии должно находится в пределах >50.000/l. Абсолютным показанием для лечения является тромбоцитопения <10.000/l независимо от срока беременности, а также при беременностях на 2 и 3 триместрах при количестве тромбоцитов между 10.000 — 30.000/l.
Методы первого выбора — это введение глюкокортикоидов (преднизон в начальной дозе 1 mg/kg веса тела в день в течение 2-4 недель) и применение иммуноглобулинов (1 g/kg веса тела в начале и повторение через 2 дня). Последнее показано, если для поддержания количества тромбоцитов на уровне > 30.000/l требуется >10 mg преднизона в день. Так как подъем тромбоцитов происходит быстро (в течение 6 часов), то применение иммуноглобулинов рационально осуществлять незадолго до родов. Если появляется резистентность к терапии, то показана комбинированная терапия глюкокортикоидами (например, метилпреднизолон 1 g/в день в течение 3 дней) и иммуноглобулинами.
В связи с трансплацентарным прохождением материнских IgG-антител у 10-25% новорожденных развивается тромбоцитопения <50.000/l и в 5% случаев <20.000/l, в любом случае внутричерепные кровоизлияния чрезвычайно редки. Акушерский подход при ITP подробно описывается в других источниках (1, 11).
Тромботическая тромбоцитопеническая пурпура
Тромботическая тромбоцитопеническая пурпура (TTP, Moschkowitz-Syndrom) — это тромботическая микроангиопатия на фоне повреждения эпителия с классическими симптомами тяжелой Coombs-негативной микроангиопатической гемолитической анемии, тромбоцитопении, лихорадки у 60% пациенток, нейрологических симптомов (судороги, преходящие гемипарезы), а также нарушениями функции почек без гематологического воздействия на плод.
Терапия
Терапией выбора считается обменное переливание плазмы, действие которой вероятно связано с удалением высокомолекулярных мультимеров von Willebrand. При этом происходит замена плазмы пациента на свежезамороженую плазму (FFP). В начале должно быть удалено 30-40 ml плазмы пациента на kg веса. Снижение этого объема забора до 15-20 ml/kg веса оправдано только, если количество тромбоцитов уве-личивается >30.000/l или, если улучшаются нейрологические и ренальные симптомы. Лечение может в основном проводится во время беременности и дает величину излечения достигающую 80% . Важно оптимальное интердисциплинарное сотрудничество с опытным гематологом. Введение тромбоцитарных концентратов противопоказано, применение глюкокортикоидов бесполезно (обзор 8, 16).
Врожденные нарушения гемостаза
Болезнь von Willebrand
Это аутосомально-доминантно наследуемое мультифакториальное заболевание с различными субтипами и распространенностью в 0,8%. При беременности и post partum кровотечения в 1-3% связаны с недостатком фактора von Willebrand (vWF). Диагностически указующим являются увеличенное время кровотечения, пониженная активность фактора VIII (FVII-IC и vWF), а также часто удлиненно PPT. Клинически импонирует типичный анамнез с кровотечениями после травм, меноррагии или геморрагии после хирургических вмешательств.
Так как во время нормальной беременности происходит увеличение фактора VI-II-комплекса, то осложнения кровотечения при беременности скорее редки (часто нормальное время кровотечения). Особое значение имеют непосредственно post partum или на 7-10 день после родов возникающие осложнения кровотечения, которые могут оказаться первыми признаками болезни von Willebrand.
Терапия
Беременные, которые ко времени родов имеют концетрацию фактора VIIIC >50U/dl и не дают симптомов, не требуют никакой терапии (до 80% тип I, снижение концентрации vWF). При уровнях <30 U/dl концентраты vWF должны вводиться до родов, а post partum терапия должна продолжаться Desmopressin (Minrin® парентерально или в виде носового спрея) (таблица 7). При типе IIb (чрезмерная реакция на Ristocitin) Desmopressin относительно противопоказан, так как иначе имеющаяся тромбоцитопения может усиливаться.
| Таблица 7 | ||
| Терапия болезни von Willebrand при беременности и post partum | ||
| Тип | Степень | Терапия |
| 1 | Слабая (vWF>30 IU/dl | Desmopressin 0,3 mg/kg веса в 50 ml 0,9% NaCl/30 мин., повтор через 12-24 часа, при отсутсвтии эффекта, затем замещение : вначале 40-60 IU/kg веса vWF затем 40-50 IU/kg веса тела |
| 1 | Средней тяжести (vWF<30 IU/dl) | 40-50 IU/kg (1 или 2 дозы) или каждые 8-12 часов в течение 3 дней, до vWf >50 IU/dl |
| 2 или 3 | Тяжелая (vWF < 30 IU/dl) | изначально 40-60 IU/kg веса затем 40-60 IU/kg веса каждые 8-12 часов в течение 3 дней до vWF > 50 IU/dl |
| vWF: фактор von Willebrand | ||
В этой ситуации и при наличии типа III необходимо post partum и в послеро довом периоде вводить концентраты плазмы (например, рекомбинантный фактор VIII-vWF). Рекомендуется следующая дозировка:
- 30-40 IU/kg веса тела начальна доза,
- 15-25 IU/kg веса каждые 12 часов в первые 3-5 дней,
- 15-25 IU/kg веса каждые 24 часа в течение дальнейших 5-7 дней.
При критически низких значениях тромбоцитов (<20.000/l) можно под защитой замещаемого vWF взвесить введение тромбоцитарных концентратов. До сих пор нет данных за то, что в связи с потенциальной опасностью кровоизлияния у плода или новорожденного Sectio caesarea имеет преимущества по сравнению с вагинальным родоразрешением.
Врожденные состояние недостатка факторов
Современный обзор чрезвычайно редких наследственных нарушений свертываемости крови в связи с дефицитом факторов свертывания I, II, V, VII, X а также XI и XIII был недавно опубликован Bolton-Maggs et al. Эти врожденные состояния дефицита имеют частоту 1:1-2 млн. и поэтому здесь не рассматриваются.
Наряду с дефицитом vWF чаще всего встречаются Х-хромосомально-рецессивно неследуемый фактор-VIII-дефицит (гемофилия А) и фактор-IX-дефицит (гемофилия В) с частотой 1-2/10.000 до 1-2/100.000.
| Таблица 8 | |
| Пограничные значения факторов свертывания нормального гемостаза | |
| Факторы коагуляции | Пограничные значения |
| Фибриноген | 100 mg/dl |
| Фактор II, V, VII, VIII, IX, X | 30-40% |
| Фактор XI | 20% |
| Фактор XII | 1% |
Для клинической повседневной практики приведенные на таблице 8 пограничные значения концентраций являются определяющими и направляющими. При беременности у женщины с гемофилией происходит существенное возрастание фактора VIII, тогда как фактор IX не проявляет никаких существенных изменений. Если поражена только одна хромосома , то при гемофилии чаще всего происходит только падение концентрации факторов на 50% от нормы (для гемостаза достаточно); у 10-20% женщин как носительниц активность однако определяется как <40%, так что существует значительный риск кровотечения.
Определение факторов должно проводиться между 28 и 32 неделями беременности и, если возможно, в родах, включая анализ свертываемости. Если фактический анализ факторов sub partu не возможен, то последний результат можно брать из 3 триместра. При уровнях <50 IU/dl должна проводиться адекватная субституция. Необходимая потребность замещения высоко очищенными концентратами фактор VIII/IX рассчитывается по формуле, где одна единица на kg веса увеличивает измеряемую активность на 1-2%. Если в реаль-ной ситуации в распоряжении нет концетрата факторов, то в исключительных случаях оправдано применение PPSB.
Частота кровоизлияний в головной мозг у гемофильных новорожденных составляет 1-4%, величина тяжелых мозговых кровоизлияний при вагинальном родоразрешении довольно невелика, и поэтому прове-дение Sectio caesarea не оправдано. Спинальная/перидуральная анестезия при концентрации факторов >50 IU и нормальной общей свертываемости возможна.
Резюме для практики
Терапией нарушения свертываемости при беременности и, прежде всего sub partu, должен владеть каждый практикующий акушер, так как он в значительной степени определяет неотложное ведение, от успеха которого зависит судьба пораженной женщины. Это касается прежде всего своевременного лечения коагулопатии потери и потребления, при которых наличие лаборатории и своевременное применение компонентов крови и замороженной плазмы являются безусловной предпосылкой каждой акушерской деятельности.
Хронические приобретенные нарушения гемостаза, как идиопатическая, так и тромботическая тромбоцитопеническая пурпура (ITP, TTP) требуют также, как и адекватная и соответствующая типу терапия болезни von Willebrand и как терапия врожденных состояний дефицита факторов, прочного интердисциплинарного сотрудничества с дифференцированным анализом свертывания и специальной заместительной терапии intra и post partum.
Источник: W. Rath, L. Heilmann. Therapie von Gerinnungsstörungen in der Schwangerschaft. Gynäkologe 2005. 38:791-798
Перевод с немецкого – Ю.М.Богданов, кафедра педиатрии ФПК Северного медуниверситета, г. Архангельск