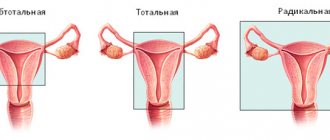
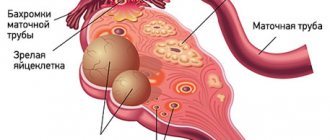
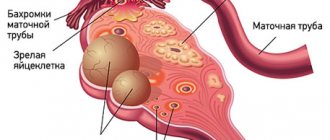
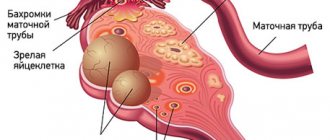
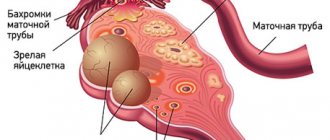
Киста — это доброкачественное новообразование в коре яичника, образующееся из-за нарушения процесса выхода желтого тела фолликула. Беременность после удаления кисты яичника — тема, которая интересует многих женщин, перенесших лапароскопию или полноценную полостную операцию. Любые функциональные нарушения в работе половых органов и хирургические вмешательства в малом тазе беспокоят женщин, т.к. теоретически снижают шанс на зачатие. Но так ли опасны кисты яичников для репродуктивной функции, как кажется многим женщинам, желающим иметь детей? Это интересно многим женщинам: и беременным, и рожавшим, и тем, кто только планирует материнство.
Может ли киста быть признаком более серьезных нарушений?
По статистике, кисты чаще всего проходят самостоятельно в течение одного или нескольких менструальных циклов, после которых возобновляется нормальная функция яичников — созревание фолликулов и выход яйцеклетки. В этом случае легко понять, можно ли забеременеть.
Но есть ряд других негативных факторов:
- гормональные сбои;
- хирургические вмешательства;
- травмы.
Они негативно влияют на женскую репродуктивную функцию в целом, и на функционирование яичников в частности. Гормональный дисбаланс — один из ключевых факторов, снижающих эффективность работы яичников и усложняющих репродуктивную функцию женщины. Когда в организме происходит изменение баланса гормонов в сторону андрогенов (тестостерона), функция яичников страдает.
Одним из опасных осложнений, снижающих способность к зачатию, является синдром поликистозных яичников. В этом состоянии на поверхности яичников образуется множество мелких кист, внутри которых находятся яйцеклетки. При изменении баланса половых гормонов в сторону андрогенов процесс выхода яйцеклеток замедляется или вовсе прекращается.
Лечения бесплодия, ассоциированного с эндометриозом
Хирургическое лечение при бесплодии остаётся первым этапом при бесплодии ассоциированном с эндометриозом.
Хирургическое лечение при бесплодии, ассоциированном с эндометриозом – прагматичный подход. ( Paolo Vercellini, Edgarto Somigliana, Paolo Vigano, Annalisa Abbiati). Было выполнено 14 РКИ, в которых наглядно продемонстрировано, что совокупная частота беременности при проведении лапароскопического лечения и удаления участков эндометриоза от 6 до 18 месяцев в 50% случаев наступает беременность. У женщин, страдающих минимальным и лёгким эндометриозом (ASRM), лапароскопическое вмешательство по сравнению с диагностической лапароскопией является эффективным методом повышения частоты беременности/живорождений. (Jacobson, и соавт. 2010). Совокупный показатель частоты спонтанной беременности в течение 3 лет варьирует от 46 до 77% при умеренном эндометриозе и от 44 до 74% при тяжёлом эндометриозе ( Nezhat и соавт., 1989).
В ходе лапароскопии подсчитывают ряд показателей Индекса Фертильности при эндометриозе ( Endometriosis fertility index (EFI), предложенного G.D. Adamson. EFI имеет прогностическое значение: позволяет предсказать время наступления беременности и использовать выжидательную тактику у пациенток с хорошим прогнозом или сразу же приступить к процедурам ВРТ при неблагоприятном прогнозе.
У женщин с бесплодием вследствие эндометриоза, которым выполняется лапароскопическое вмешательство до применения ВРТ, клиницисты могут рассмотреть возможность полного хирургического удаления эндометриоидных очагов с целью улучшения частоты живорождениям( Opoien и соавт., 2011).
Влияет ли операция на способность к зачатию?
Киста яичника образуется, когда по какой-то причине созревший фолликул не разрывается, выпуская яйцеклетку в фаллопиеву трубу по направлению к матке, а остается в яичнике. Под воздействием гормонов фолликул начинает наполняться жидкостью, образуя мешочек диаметром от нескольких миллиметров до нескольких сантиметров. Происходит это под влиянием женских и мужских половых гормонов, стрессов, травм и других факторов.
Можно ли забеременеть в этом случае? Одиночная киста не всегда означает серьезное нарушение. Если по показанию гинеколога киста была удалена, то способность к зачатию и вынашиванию ребенка сохраняется. Беременность после кисты яичника вполне возможна, если женщина будет соблюдать простые правила после операции.
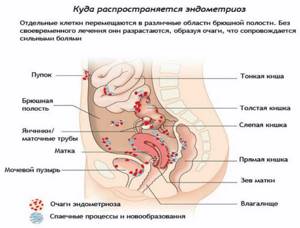
Эндометриоз и бесплодие – проблемы современной женщины
Эндометриоз является одной из актуальных проблем современной медицины, оставаясь в ряду самых загадочных и труднообъяснимых заболеваний. Частота эндометриоза, по данным разных исследователей, варьирует от 12 до 50% у женщин репродуктивного возраста. Согласно последним данным, эндометриозом во всем мире страдают примерно 176 млн женщин преимущественно репродуктивного возраста – каждая десятая. В России в структуре гинекологической патологии ГЭ занимает третье место (после воспалительных заболеваний и лейомиомы матки).
Частота выявления эндометриоза при лапароскопии, в том числе проводимой с целью уточнения причины бесплодия, составляет 20-55%. Среди обращающихся в центры вспомогательных репродуктивных технологий для проведения ЭКО более 30% пациенток имеет наружный генитальный эндометриоз.
Как избежать осложнений?
Главное после хирургического вмешательства в полости малого таза — избежать образования спаек. Чтобы восстановить кровообращение в репродуктивных органах, на следующий день после операции женщина должна начать двигаться. Во избежание воспаления после операции назначают антибиотики в течение 5-7 дней.
В гинекологической практике перед операцией по удалению кисты гинеколог назначает обследование гормонального фона, чтобы понять, можно ли забеременеть женщине вообще. Если специалист обнаруживает, что есть дисбаланс гонадотропинов (половых гормонов), то после удаления кисты доктор назначает прием гормональных препаратов для восстановления нормальной функции эндокринной системы. Обычно полное устранение всех неблагоприятных факторов, влияющих на зачатие, происходит в течение 2-3 месяцев.
Представлены возможности лапароскопических операций у беременных женщин при хирургической и гинекологической патологии: при желчнокаменной болезни, аппендиците, грыжах передней брюшной стенки, заболеваниях придатков матки, миоматозных узлах. Описаны преимущества лапароскопии, возможные осложнения в виде ацидоза либо повреждений матки троакаром, их профилактика. Показано, что оптимальные результаты дают плановые операции, выполняемые во втором триместре беременности. Особое внимание уделено проблеме предупреждения разрыва матки на фоне беременности после перенесенной ранее консервативной миомэктомии.
Laparoscopic surgery and pregnancy
Possibilities of laparoscopic surgery in pregnant women with surgical and gynecological pathologyare presented: with gallstones, appendicitis, hernia of the anterior abdominal wall, diseases of the uterine appendages, myomatosis nodes. The advantages of laparoscopic surgery, possible complications as acidosis or uterine trocar injuries, their prevention are described. Shown that optimal results provide planning surgeries performed in the second trimester of pregnancy. Particular attention is paid to the prevention of uterine rupture in pregnancy after undergoing before conservative myomectomy.
Осложнения лапароскопии у беременных
Беременность представляет уникальный вызов хирургу при необходимости выполнения плановых и ургентных операций. И не только потому, что речь идет о двух человеческих жизнях. При беременности многие физиологические параметры претерпевают существенные изменения: кардиопульмонарные, свертываемость крови, уровень гемоглобина, артериальное давление. По мере прогрессирования беременности хирургическая визуализация существенно меняется, не говоря о доступе. Та или иная операция на органах брюшной полости бывает необходима по ходу беременности одной из 150 женщин [1].
Традиционно беременность считали абсолютным противопоказанием для лапароскопии, но в последнее десятилетие она вышла вперед в лечении гинекологической и негинекологической патологии, в пику лапаротомии. Наиболее частая операция при беременности — холецистэктомия (45-48% процедур), вмешательства на придатках матки (28-34%) и аппендэктомия (15-16%). Каждая из них дает хороший результат в опытных руках [2].
Существует несколько показаний к гинекологической хирургии при беременности: доброкачественные кисты яичника, перекрут придатков матки, рак и в редких случаях некроз миоматозного узла. Предполагается, что у одной из 81 беременной женщины находят кисту яичника. Выявляемость повысилась в последние годы по мере широкого внедрения УЗИ. Однако всего у одной из 600 женщин во II триместре беременности обнаруживают доброкачественные кисты яичника, требующие хирургического лечения [3].
Большинство кист, обнаруживаемых на УЗИ, оказываются кистами желтого тела, они рассасываются самостоятельно. К сожалению, в некоторых случаях клиническая ситуация требует немедленной интервенции до ожидаемого рассасывания. Перекрут яичника обычно наблюдают в I триместре с частотой 1 на 5000 беременностей [4].
Показания к операциям на яичниках при беременности диктуют два фактора: опасность малигнизации кист, составляющая 1-8%, и вероятность осложнений в виде перекрута, разрыва, кровотечения с частотой 10-42%. Опасность преждевременных родов после ургентной операции значительно выше, чем после плановой. Поэтому риск выжидательной тактики и отказа от хирургии весьма велик [5, 6].
Преимущества лапароскопии. Для лечения заболеваний, возникающих на фоне беременности, лапароскопия имеет существенные отличия от лапаротомии. Во-первых, это те же преимущества, что и у небеременных женщин: снижение продолжительности койко-дней и сроков реабилитации, уменьшение частоты осложнений и потребности в наркотических препаратах, что важно для жизнедеятельности плода [7, 8].
Ранее существовавшее мнение об опасности лапароскопии в сравнении с лапаротомией для жизни плода не подтвердилось многочисленным опытом последних лет. В большом шведском ретроспективном исследовании 2181 лапароскопии и 1522 лапаротомий, выполненных по ходу беременности за два десятилетия, не было различий в весе, продолжительности беременности, врожденных пороках, мертворождении и неонатальных смертях [9]. Два ретроспективных исследования, проведенных в Израиле, подтвердили то же самое [7, 10].
Теоретически лапароскопия дает лучшую визуализацию и требует меньших манипуляций с маткой, что в последующем предотвращает ранние роды. Лапароскопия эффективнее в диагностическом плане, что особенно важно для исключения острого аппендицита (ОА). От 35 до 50% случаев подозрения на ОА в третьем триместре оказывается негативным. Ошибки в этой ситуации весьма печальны, многие осложнения связаны с задержкой диагноза воспаления червеобразного отростка. Снижение продолжительности заболевания благодаря диагностической лапароскопии представляет идеальную хирургическую модель разрешения дилеммы, обязательно присутствующей в критической ситуации. Muench с соавторами показали, что задержка операции при желчнокаменной болезни увеличивает продолжительность болезни в сравнении со своевременным лапароскопическим лечением [11].
Одно из возможных преимуществ лапароскопии в сравнении с лапаротомией — снижение риска тромботических осложнений. Венозный стаз и физиологические факторы, связанные со сгущением крови при беременности, увеличивают риск катастрофических осложнений в общей популяции. Хирургия только увеличивает этот риск. Многие врачи верят, что ранняя способность передвигаться после операции, обусловленная малоинвазивной хирургией, может существенно уменьшить этот риск для пациентки [12].
Профилактика осложнений. Давно существовавший запрет на лапароскопию у беременных основывался в большей степени на теоретическом риске, связанном с инсуффляцией и пневмоперитонеумом (ПП). Беременность, как и ожирение, существенно изменяет механизм легочной вентиляции пациентки. Метаболические потребности организма возрастают, а остаточная емкость легких уменьшается по мере прогрессирования беременности. Общая анестезия, увеличение внутрибрюшного давления СО2, ПП, положение на спине, положение Трендленбурга — все вместе усугубляют эти проблемы. Результатом может быть респираторный ацидоз, ателектазы и гипоксемия. Если эти явления не ликвидировать, наступит эмбриональный ацидоз и гипоксемия плода. Кардиальный индекс снижается по мере введения в наркоз, как и у небеременных. Снижается артериальное давление и системная сосудистая резистентность.
Ацидоз плода при инсуффляции 10-15 мм рт. ст. изучали на беременных овцах. Гипоксемия у эмбрионов отсутствовала. Другая опасность ацидоза плода связана с увеличением внутрибрюшного давления, включая уменьшение материнского венозного возврата и сердечного выброса, уменьшением маточного кровотока и трансперитонеальной и плацентарной абсорбции СО2. Данные гипотетические положения были отвергнуты исследованиями на животных. Все это не сказалось на течении беременности у овец, враждебное воздействие ПП на состояние плода не было доказано [13, 14].
Другая опасность состоит в повреждении беременной матки первым троакаром или иглой Вереша. Вероятность этого осложнения зависит от размеров матки. Описаны случаи пневмоамниона с потерей плода во втором триместре гестации [15]. По мере прогрессирования беременности безопасное введение первого троакара все более затруднено. Показана техника открытой лапароскопии по Хассону.
После 18 недель беременности первичный троакар вводят значительно выше пупка, на протяжении, между ним и мечевидным отростком грудины. Можно использовать левый верхний квадрант брюшной стенки или УЗИ-контроль за введением иглы [16, 17].
Плановую лапароскопическую операцию идеально выполнять во втором триместре, когда органогенез завершен, а матка еще не столь велика, как в III триместре, хотя визуализация внутренних органов в I триместре, естественно, проще. Откладывать операцию до III триместра нежелательно из-за плохой визуализации и потенциальной опасности преждевременных родов. Большинство авторов не используют рутинно токолитики после лапароскопии, хотя индометацин, кетопрофен и ритодрин дают хорошие результаты при повышенном тонусе матки после лапароскопии [18].
Для снижения опасности тромбоэмболии показаны пневматические компрессионные чулки и ранняя активизация. Следует внимательно отслеживать после операции материнскую гипоксию, тахикардию, возможность развития плеврита и артериальную гипертонию [19].
Разрыв матки после лапароскопической миомэктомии
Это осложнение хорошо известно с прошлого столетия. Курт Земм выполнил первую лапароскопическую миомэктомию в 1979 году, в следующем десятилетии в англоязычной литературе описано минимум 13 спонтанных разрывов матки в позднем втором или раннем и среднем третьем триместре после лапароскопической миомэктомии. Все они произошли до начала родов [20, 21]. В целом разрыв матки после консервативной миомэктомии наблюдают в 0,33% случаев [22]. Хотя в отдельных наблюдениях частота этого осложнения достигает 2,5% [23].
Главная причина осложнения — неполноценное ушивание раны матки либо оставление «мертвого пространства», что приводит к образованию внутриматочных гематом и ухудшает заживление раны. Следует помнить, что в технике шва гинекологи небольшие мастера. Монополярная электрохирургия и плохое сопоставление краев раны также играют определенную роль в опасности разрыва [24-26].
Профилактика. Ввиду напряжения матки при беременности женщины, планирующие беременность после лапароскопической миомэктомии, должны быть тщательно отобраны для этой операции. При наличии более четырех миом или при размерах доминирующей миомы более 7-10 см в диаметре, показана лапаротомия как наиболее эффективная процедура. Осторожность необходима при локализации миоматозных узлов по задней стенке, так как они более сложны для ушивания, чем образования, локализующиеся в дне и по передней стенке матки. Наложение шва особенно затруднено при локализации миоматозных узлов по задней стенке. Анализ литературы показывает, что при такой локализации миомы хирурги ранее ушивали только серозную оболочку или вообще этого не делали. В случае соблюдения данных ограничений лапароскопический доступ предпочтительнее [27, 28].
Важность хирургической техники для профилактики разрыва матки нельзя преувеличить. Тем не менее минимизация термального воздействия на ткани в процессе энуклеации миомы — первый важный шаг в профилактике возможных осложнений. Особо это касается использования монополярной энергии в режиме коагуляции в нижнем сегменте матки, с продолжительным воздействием на ткани. Ножницы, ультразвуковой скальпель, монополярная электрохирургия в режиме резания и лазер более предпочтительны, так как минимизируют ожог миометрия. Другой важный момент — надежный гемостаз. Некоторые хирурги рекомендуют субсерозное введение вазопрессина до разреза матки, некоторые советуют до операции лечение агонистами гонадотропин-релизинг гормона на протяжении 1-3 месяцев.
Обеспечить надежный гемостаз холодными ножницами или монополярным резанием довольно сложно. Поэтому рекомендуют гармонический скальпель или лазер для первичного рассечения матки. Возможно и простое вывихивание узла с тупой диссекцией. Одно из преимуществ эндохирургии — четкая визуализация сосудистой ножки, ее можно обработать в биполярном режиме. Если кровотечение продолжается, следует применить фульгурацию на большой поверхности. Наиболее надежный метод гемостаза — ушивание раны. Все слои матки должны быть сближены и мертвое пространство — ликвидировано. Сероза всегда должна быть ушита, даже при миомах на ножке и поверхностных субсерозных миомах. Полноценная герметизация требует наложения 2-4 рядов швов. В случае проникновения в полость матки эндометрий должен быть ушит отдельно от вышележащего миометрия. Возможно использование узлового или непрерывного шва, но ушивание должно быть надежным [29, 30].
Применение сшивающих аппаратов может встретить определенные трудности в лапароскопической хирургии. Однако результаты показывают надежность этих швов при последующей беременности и родах. Для контроля герметичности швов возможно введение в цервикальный канал метиленового синего. Заживление раны матки и толщину миометрия после операции, но до беременности, можно контролировать при помощи УЗИ или МРТ. Вопрос о продолжительности паузы между миомэктомией и беременностью окончательно не решен. Прочность рубца миометрия достигает дооперационного уровня через 6-12 недель. Благоразумный промежуток между операцией и беременностью начинается от трех месяцев [31, 32].
Распознавание. В литературе не описано ни одного случая разрыва матки во время родов после выполненной ранее консервативной лапароскопической миомэктомии. Дородовые разрывы наблюдают на сроках от 17 до 35 недель гестации с преобладанием конца второго или начала третьего триместра. Любая женщина с миомэктомией в анамнезе, независимо от доступа, с болями в животе после 20 недель гестации должна быть рассмотрена как пациентка с подозрением на разрыв матки. Симптомы руптуры вариабельны и неспецифичны. Характерна острая боль внизу живота, тахикардия плода синхронна с болевым синдромом. Исход для матери и ребенка зависит от степени кровопотери и глубины гиповолемического шока. При угрозе разрыва наиболее информативно определение целостности миометрия методом МРТ [33, 34].
Лечение. Разрыв матки требует немедленного кесарева сечения. Линия разрыва должна быть ушита многорядным швом, как при открытой миомэктомии. Перед каждой женщиной, перенесшей лапароскопическую миомэктомию, встанет вопрос: перенесет она роды или нет? Безусловно, каждый акушер в такой ситуации внимательно осматривает рубец и нередко рекомендует кесарево сечение до наступления родов. Нет данных, что оперативное родоразрешение в этой ситуации безопаснее. Успешные вагинальные роды после лапароскопической миомэктомии наблюдали в 38% случаев без единого разрыва матки [35].
И.В. Федоров
Казанская государственная медицинская академия
Федоров Игорь Владимирович — доктор медицинских наук, профессор кафедры эндоскопии, общей и эндоскопической хирургии КГМА
Литература:
1. Lachman E., Schienfeld A., Voss E. et al. Pregnancy and laparoscopic surgery. J Am Assoc Gynecol Laparosc 1999; 6: 347.
2. Reedy M.B., Galan H.L., Richards W.E. et al. Laparoscopy during pregnancy. A survey of laparoendoscopic surgeons. J Reprod Med 1997; 42: 33.
3. Fatum M., Rojansky N. Laparoscopic surgery during pregnancy. Obstet Gynecol Surv 2001; 56: 50.
4. Wang C.J., Yen C.F., Lee C.L., Soong Y.K. Minilaparoscopic cystectomy and appendectomy in late second trimester. JSLS 2002; 6: 373.
5. Stepp K.J., Tulikangas P.K., Goldberg J.M. et al. Laparoscopy for adnexal masses in the second trimester of pregnancy. J Am Assoc Gynecol Laparosc 2003; 10: 55.
6. Stepp K., Falcone T. Laparoscopy in the second trimester of pregnancy. Obstet Gynecol Clin North Am 2004; 31: 485.
7. Oelsner G., Stockheim D., Soriano D. et al. Pregnancy outcome after laparoscopy or laparotomy in pregnancy. J Am Assoc Gynecol Laparosc 2003; 10: 200.
8. Curet M.J., Allen D., Josloff R.K. et al. Laparoscopy during pregnancy. Arch Surg 1996; 131: 546.
9. Reedy M.B., Kallen B., Kuehl T.J. Laparoscopy during pregnancy: A study of five fetal outcome parameters with use of the Swedish Health Registry. Am J Obstet Gynecol 1997; 177: 673.
10. Soriano D., Yefet Y., Seidman D.S. et al. Laparoscopy versus laparotomy in the management of adnexal masses during pregnancy. Fertil Steril. 1999; 71: 955.
11. Muench J., Albrink M., Serafini F. et al. Delay in treatment of biliary disease during pregnancy increases morbidity and can be avoided with safe laparoscopic cholecystectomy. Am Surg 2001; 67: 539.
12. Carter J.F., Soper D.E. Operative laparoscopy in pregnancy. JSLS, 2004; 8: 57.
13. Chan J.K., Morrow J., Manetta A. Prevention of ureteral injuries in gynecologic surgery. Am J Obstet Gynecol 2003; 188: 1273.
14. Williams T J. Urologic injuries. Obstet Gynecol Annu 1975; 4: 347.
15. Berkmen R., Peker A.E., Alagol H. et al. Treatment of iatrogenic ureteral injuries during various operations for malignant conditions. J Exp Clin Cancer Res 2000; 19: 441.
16. Wood E.C., Maher P., Pelosi M.A. Routine use ofureteric catheters at laparo-scopic hysterectomy may cause unnecessary complications. J Am Assoc Gynecol Laparosc 1995; 3: 393.
17. Dwyer P.L., Carey M.P., Rosamilia A. Suture injury to the urinary tract in urethral suspension procedures for stress incontinence. Int Urogynecol J Pelvic Floor Dysfunct 1999; 10: 15.
18. Fatum M., Rojansky N. Laparoscopic surgery during pregnancy. Obstet Gynecol Surv 2001; 56: 50.
19. Rizzo A.G. Laparoscopic surgery in pregnancy: Long-term follow-up. J Laparoendosc Adv Surg Tech A 2003; 13: 11.
20. Nouira Y., Oueslati H., Reziga H., Horchani A. Ureterovaginal fistulas complicating laparoscopic hysterectomy: A report of two cases. Eur J Obstet Gynecol Reprod Biol 2001; 96: 132.
21. Oh B., Kwon D., Park K. et al. Late presentation of ureteral injury after laparoscopic surgery. Obstet Gynecol 2000; 95: 337.
22. Nezhat C., Nezhat F. Laparoscopic repair of ureter resected during operative laparoscopy. Obstet Gynecol 1992; 80: 542.
23. Liu C.Y., Kim J.H., Bryant J.F. Laparoscopic ureteroureteral anastomosis of the distal ureter. J Am Assoc Gynecol Laparosc 2001; 8: 412.
24. Seinera P., Farina C., Todros T. Laparoscopic myomectomy and subsequent pregnancy: Results in 54 patients. Hum Reprod 2000; 15: 1993.
25. Seinera P., Arisio R., Decko A. et al. Laparoscopic myomectomy: Indications, surgical technique and complications. Hum Reprod 1997; 12: 1927.
26. Ribeiro S.C., Reich H., Rosenberg J. et al. Laparoscopic myomectomy and pregnancy outcome in infertile patients. Fertil Steril 1999; 71: 571.
27. Oktem O., Gokaslan H., Durmusoglu F. Spontaneous uterine rupture in pregnancy 8 years after laparoscopic myomectomy. J Am Assoc Gynecol Laparosc 2001; 8: 618.
28. Hasson H.M., Rotman C., Rana N. et al. Laparoscopic myomectomy. Obstet Gynecol 1992; 80: 884.
29. Hasbargen U., Summerer-Moustaki M., Hillemanns P. et al. Uterine dehiscence in a NULLipara, diagnosed by MRI, following use of unipolar electrocautery during laparoscopic myomectomy: Case report. Hum Reprod 2002; 17: 2180.
30. Pelosi M.A. 3rd, Pelosi M.A. Spontaneous uterine rupture at thirty-three weeks subsequent to previous superficial laparoscopic myomectomy. Am J Obstet Gynecol 1997; 177: 1547.
31. Seinera P., Arisio R., Decko A. et al. Laparoscopic myomectomy: Indications, surgical technique and complications. Hum Reprod 1997; 12: 1927.
32. Dubuisson J.B., Fauconnier A., Chapron C. et al. Second look after laparo-scopic myomectomy. Hum Reprod 1998; 13: 2102.
33. Stringer N.H., Strassner H.T., Lawson L. et al. Pregnancy outcomes after laparoscopic myomectomy with ultrasonic energy and laparoscopic suturing of the endometrial cavity. J Am Assoc Gynecol Laparosc 2001; 8: 129.
34. Dubuisson J.B., Fauconnier A., Deffarges J.V. et al. Pregnancy outcome and deliveries following laparoscopic myomectomy. Hum Reprod, 2000; 15: 869.
35. Landi S., Fiaccavento A., Zaccoletti R. et al. Pregnancy outcomes and deliveries after laparoscopic myomectomy. J Am Assoc Gynecol Laparosc, 2003; 10: 177.
Приводят ли осложнения после операции к бесплодию?
При благоприятном развитии ситуации в послеоперационный период (отсутствие воспалений, спаек, гормональных сбоев) женщине удается забеременеть после полноценного восстановления организма.
Если во время операции или в послеоперационный период возникают осложнения, то функция яичника, на котором была киста, может незначительно снизиться. Например, спаечный процесс в фаллопиевой трубе может затруднить движение яйцеклетки к полости матки для оплодотворения. Но и в этом случае детородная функция женщины сохраняется. Если киста поразила только один из яичников, а второй здоров, то ответ на вопрос, можно ли забеременеть — положительный. Как парный орган, яичники работают попеременно: в один менструальный цикл фолликул созревает в правом, во второй — в левом. Бывают циклы и вовсе без овуляции, когда яичники «отдыхают».
Если после удаления кисты не получается забеременеть
Теоретически удаление кисты должно повысить шансы на зачатие, т.к. после удаления инородного тела яичник получает импульс, стимулирующий выход яйцеклетки. Если же после процедуры сохраняются проблемы с зачатием, хотя осложнений после операции не возникло, то можно предположить другую причину снижения фертильности.
Чаще всего мешают забеременеть:
- синдром «ленивого» яичника, когда овуляции происходят достаточно редко;
- истощение яичников;
- гормональный дисбаланс, затрудняющий овуляцию;
- скрытый воспалительный процесс матки или придатков.
Чтобы точно выявить причину, врач-гинеколог должен провести комплексное обследование, включая анализ крови на половые гормоны (эстроген, прогестерон, тестостерон), УЗИ органов малого таза. В зависимости от результата обследования, врач может назначить гормональную терапию для стимуляции овуляции, а также физикальное лечение в случае эндометриоза, непроходимости маточных труб или других заболеваний женских репродуктивных органов. Предпочтение лучше отдать методам естественным и щадящим. Отличный пример — пептидный биорегулятор Овариамин. Он фокусно действует на яичники, способствуя восстановлению функционального резерва их клеток, тем самым участвует в подготовке яичников к зачатию.
Таким образом, забеременеть после удаления кисты возможно, главное — следовать рекомендациям лечащего врача и пользоваться современными безопасными средствами для восстановления и поддержания физиологической функции яичников.
Поделиться: