Острый панкреатит (ОП) — это первоначально асептическое воспаление поджелудочной железы, при котором возможно поражение окружающих тканей, отдаленных органов и систем.
В настоящее время распространенность острого панкреатита составляет 34 случая на 100000 населения, смертность от данного заболевания составляет 1,16 на 100000 населения ежегодно. Кроме того, в 20 % случаев развиваются повторные приступы острого панкреатита, которые могут приводить к развитию диабета и/или хронического панкреатита [1].
Среди этиологических причин выделяют следующие [2]:
- нарушение оттока панкреатического секрета в связи с билиарной гипертензией (40 %);
- длительный прием алкоголя (30 %);
- гиперглицеринемия (2–5 %);
- прочие (аутоиммунные процессы, сосудистая недостаточность, васкулиты, лекарственные препараты (гипотиазид, стероидные и нестероидные гормоны, меркаптопурин), инфекционные заболевания (вирусный паротит, гепатит, цитомегаловирус), аллергические факторы (лаки, краски, запахи строительных материалов, анафилактический шок), дисгормональные процессы при беременности и менопаузе, заболевания близлежащих органов (гастродуоденит, пенетрирующая язва, опухоли гепато-панкреато-дуоденальной области).
Пусковым механизмом при билиарном ОП являются желчные камни и сладж-синдром желчного пузыря в области ампулы фатерова сосочка, что приводит к повышению давления во внутрипанкреатических протоках, сопровождающееся накоплением богатой ферментами жидкости в межуточной ткани железы. Поскольку липаза — один из немногих ферментов, секретируемых в активной форме, происходит повреждение клеток [3].
Длительный прием этил-содержащих продуктов приводит к гиперактивации холецистокинина, чем обуславливается преждевременное активирование зимогенов ферментов. Кроме того, алкоголь усиливает повреждающий эффект при помощи активации транскрипционных факторов, ядерного фактора kB (NF-κB) и активирующего белка-1(A-1). Это приводит к образованию токсичных метаболитов — ацетальдегида и этиловых эфиров жирных кислот. Что, в свою очередь, вызывает оксидативный стресс и нарушение работы паренхимы поджелудочной железы [4].
Для объяснения ОП, обусловленного гиперглицеринемией, существует две теории. Согласно первой, избыток триглицеридов транспортируется в виде богатых триглицеридами липопротеинов (хиломикронов), которые гидролизуются в сосудистом русле поджелудочной железы. Это высвобождает высокое количество свободных жирных кислот, которое альбумины связать не в состоянии, что влечет к образованию несвязанных жирных кислот, которые повреждают тромбоциты, эндотелиоциты и ацинарные клетки. Все это приводит к ацидозу, усиливающему токсичность свободных жирных кислот и обуславливающему активацию трипсиногена.
По второй, повышенное количество хиломикронов вызывает увеличение вязкости плазмы, сопровождающееся нарушением микроциркуляции, которое вызывает ишемию и, как следствие, ацидоз и повреждение клеток. Вполне вероятно, обе эти теории дополняют друг друга (рис. 1) [5].
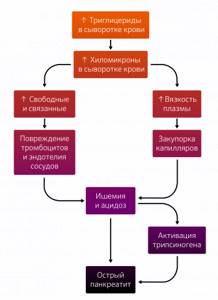
Рисунок 1 | Возможные патофизиологические механизмы гиперглицеридного панкреатита
Естественно, пусковых механизмов, как и этиологических причин — множество. Однако зацикливаться на них не стоит, так как патогенез ведущих причин не до конца изучен, а редко встречаемые формы зачастую представлены голой теорией. К тому же поодиночке они зачастую не работают: алкоголь спазмирует сфинктер Одди, что вызывает внутрипротоковую гипертензию; длительный прием алкоголя приводит к вторичной гиперглицеринемии; а ожирение является фактором риска развития желчнокаменной болезни. И, самое главное, независимо от триггера, все пути сходятся в одной точке — активации трипсиногена [4].
Однако, прежде чем продолжить, сделаем некоторое отступление, чтобы раскрыть защитные механизмы клеток поджелудочной железы, так как внутриклеточная активация ферментов происходит и в физиологическом состоянии, а нарушение данных механизмов обуславливает значительную часть идиопатических ОП. Внутриклеточная активация состоит из [4]:
- панкреатического секреторного ингибитора трипсина (PSTI или SPINK1), который связывает и инактивирует около 20 % активированного фермента;
- аутолиза преждевременно активированного трипсина аутофагосомами;
- мезотрипсина и фермента Y, которые инактивируют и лизируют трипсин;
- неспецифических антипротеаз, таких как альфа-1 антитрипсин и альфа-2-макроглобулины, которые присутствуют в интерстиции поджелудочной железы.
Теперь вернемся к патогенезу. В результате воздействия повреждающих факторов происходит нарушение работы клеток, что обуславливает начальный этап ОП, который разделяется на 3 составные части:
- внутриклеточная активация пищеварительных ферментов;
- нарушение микроциркуляции;
- появление воспаления.
Внутриклеточная активация ферментов
Как уже говорилось ранее, центральную позицию занимает активация трипсиногена. На данный момент основную роль отводят катепсину B — белку цистеиновой протеазы, который находится в лизосомах человека. В норме комплекс Гольджи не допускает слияния вакуолей с пищеварительными ферментами и лизосомами, однако при патологическом состоянии сортировка нарушается и происходит их слияние. Катепсин B активирует трипсиноген внутри вакуоли. Она не способна выстоять против агрессивного содержимого и разрывается. В матриксе клетки появляется большое количество активированного трипсина, с которым защитные механизмы справиться не в состоянии. Активированный трипсин приводит к образованию все нового трипсина из трипсиногена, а также к «включению» других панкреатических ферментов, таких как фосфолипаза, химотрипсин и эластаза, и нарушению регуляции прочих ферментных каскадов, включая комплемента, калликреин-кининовый и фибринолиза.
Показания
Желчь синтезируется клетками печени и по внутрипеченочным протокам собирается в желчном пузыре, лежащим на нижней поверхности печени. Через некоторое время после еды желчь из пузыря подается в двенадцатиперстную кишку, где она взаимодействует с полупереваренной пищей, расщепляя её компоненты на составные части. Желчный пузырь и двенадцатиперстная кишка соединены общим желчным протоком, куда чуть выше кишки впадает проток поджелудочной железы.
При холангиографии контрастное для рентгена вещество окрашивает внепеченочные протоки, показывая их структуру и проходимость, фиксируя места сужения и причину сужения. Поэтому к холангиографии прибегают в случаях:
- Желтухи неинфекционной природы, когда из-за механического препятствия нормальному току желчи желчные кислоты попадают не в кишку, а всасываются в кровь, что возможно при закупорке главного желчного протока — холедоха камнем, сдавлении его рубцами, а также блокировке опухолью дуоденального сосочка — места впадения протока в двенадцатиперстную кишку.
- Рака поджелудочной железы, когда необходимо восстановить проходимость сдавленного раковым конгломератом холедоха специальным дренажом или стентом, чтобы улучшилось состояние, регрессировала механическая желтуха и больного подготовили к плановой операции.
- Воспаления поджелудочной железы с частыми обострениями для поиска причины хронизации патологии.
- Наличия патологических гнойных ходов — свищей между поджелудочной и двенадцатиперстной, сформировавшихся после тяжелого панкреатита.
После установления точной причины патологии желчевыведения, холангиография из диагностического мероприятия может стать лечебной процедурой, ликвидирующей это патологическое препятствие.

Воспаление
На все это буйство реагирует иммунная система. К очагу повреждения мигрируют гранулоциты и макрофаги. Они начинают выделять провоспалительные вещества:
- цитокины (фактор некроза опухоли, интерлейкины 1, 6 и 8);
- метаболиты арахидоновой кислоты (простагландины, активирующий тромбоциты фактор и лейкотриены);
- протеолитические и липолитические ферменты;
- активные метаболиты кислорода, которые перегружают и без того не справляющуюся антиоксидантную систему.
В итоге, значительное количество повреждающих факторов — активированные энзимы, нарушение кровоснабжения, синтез провоспалительных медиаторов и избыток оксидов — приводит к обширной гибели ткани поджелудочной железы и наступает некротизирующий панкреатит, развивающийся в 20 % случаев.
На этом заканчивается начальный этап ОП, который схематично выглядит следующим образом (рис. 2). Естественно, это модель, в реальности патологические изменения происходит не одновременно, состояние органа у каждого пациента индивидуально.
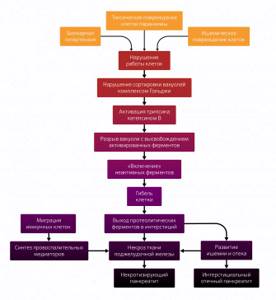
Рисунок 2 | Схема патогенеза ОП
При легкой степени ОП все может закончиться и на начальном этапе, однако при развитии некротизирующего панкреатита начинаются системные изменения в организме, которые клинически разделяются на две фазы. I фаза — ранняя, в свою очередь подразделяется на два периода.
IА фаза — первая неделя — на организм воздействуют агрессивные протеолитические ферменты и большое количество медиаторов воспаления, попадающие в системный кровоток, а также гиповолемия, на фоне многократной рвоты, отека и выпота в серозные полости.
В целом это приводит к метаболическому сдвигу в виде гипокальциемии, гиперлипидемии, гипергликемии/гипогликемии и диабетическому кетоацидозу, к ДВС–синдрому и системному воспалительному ответу.
По системам:
- поражение легких обусловливается разрушением сурфактанта фосфолипазой А на фоне ДВС–синдрома, что приводит к респираторному дистресс-синдрому;
- поражение сердца происходит в результате метаболического сдвига, гиповолемии и других факторов, угнетающих миокард, что приводит к падению артериального давления вплоть до шока;
- гиповолемия и падение артериального давления угнетает работу почек вплоть до острой почечной недостаточности;
- в свою очередь, печень, стараясь вернуть содержимое системного кровотока к гемостатическому идеалу, не справляется с непосильной работой и срывается в печеночную недостаточность.
Отдельно здесь стоит развитие абдоминального компартмент-синдрома. Воздействие протеолитических ферментов, провоспалительных цитокинов на фоне метаболических сдвигов и ДВС–синдрома на клетки серозной оболочки приводит к активному транссудированию жидкости во внутренние пространства организма. Развившийся асцит, а также выраженный отек парапанкреатической клетчатки приводят к повышению внутрибрюшного давления, что обуславливает развитие абдоминального компартмент-синдрома, являющегося ургентным хирургическим состоянием, обуславливающим развитие полиорганной недостаточности [6].
Так проходит IА фаза некротического панкреатита, в котором содержится первый пик летальности ОП, связанный с органной или полиорганной недостаточностью.
IB фаза — как правило вторая неделя — связана с восстановлением гемостаза и ответом организма на сформировавшиеся очаги некроза в органе и околоорганной клетчатке.
Затем наступает II фаза — поздняя фаза, фаза секвестрации. Очаги некроза подвергаются расплавлению с образованием псевдокист и свищей, если в зоне некроза находилась протоковая система железы. Так происходит если к секвестрам не присоединяется инфекция.
Дело в том, что первая фаза не проходит бесследно для желудочно–кишечного тракта. Гиповолемия, падение артериального давления и раскрытие артериовенозных шунтов в кишечнике, происходящее в ответ на падение артериального давления, приводит к ишемии стенок кишечника. Это снижает ее барьерную функцию и обуславливает возможность транслокации бактерий из просвета желудочно-кишечного тракта в брыжеечные лимфатические узлы и более отдаленные участки [7]. Обсемененность близких к поджелудочной железе тканей обуславливает столь частое инфицирование — 20–40 % [8]. Именно инфекционный процесс обуславливает второй пик смертности, связанный с развитием инфекционного процесса. После его купирования наступает выздоровление.
ОП чаще всего начинается остро на фоне обильного приема пищи и/или алкоголя или после приступа острой печеночной колики — болью, тошнотой и многократной рвотой.
Боль носит продолжительный (более 30–60 мин), выраженный, опоясывающий характер, располагается в эпигастрии без четкой локализации, усугубляется при положении лежа на спине и иррадиирует в нее у 50 % пациентов [9].
Физикальные проявления зависят от тяжести заболевания. При осмотре выявляются вздутие живота, гиперемия лица, «мраморность» или цианоз кожи живота и периферических частей тела. В очень редких случаях при тяжелом панкреатите могут наблюдаться пятна Каллена (рис. 3), расположенные параумбиликально, или пятна Грея–Турнера, расположенные на левой боковой стенке живота. .
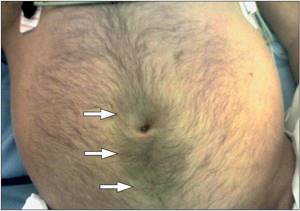
Рисунок 3 | Пятна Каллена
Пальпаторные проявления варьируют от болезненности до выраженной мышечной защиты и перитонеальных синдромов. Здесь может помочь симптом Губергрица — болезненность, возникающая при надавливании в точке, лежащей на 6 см выше пупка, на линии, соединяющей его с левой подмышечной впадиной. Симптом Джанелидзе — уменьшение боли при углубленной пальпации надчревной области характерно для инфаркта миокарда, а усиление боли — для острого панкреатита. И симптом Мейо–Робсона — болезненность при пальпации левого реберно-позвоночного угла (проекция хвоста поджелудочной железы). Перкуторно/аускультативно выявляются признаки пареза кишечника[10].
Согласно Атлантской классификации, чтобы поставить диагноз ОП, требуется наличие двух из следующих трех признаков [11]:
- характерная абдоминальная боль (острая, персистирующая, выраженная эпигастральная боль, часто с иррадиацией в спину);
- показатели сывороточной липазы (амилазы) по крайней мере в 3 раза выше верхней границы нормы;
- характерные признаки ОП при КТ с контрастным усилением либо, реже, магнитно-резонансной томографии (МРТ) или трансабдоминальном УЗИ.
Постоянным признаком является характерный болевой синдром. По-другому дело обстоит с двумя другими критериями.
Липаза и амилаза появляются в результате гибели клеток. Причем амилаза нарастает быстрее, достигая значимых показателей в течение пары-тройки часов. Но она же быстро возвращается к нормальным цифрам, в течение 3–5 дней, что делает ее неактуальной при позднем обращении. К тому же в 19 % случаев ОП уровень амилазы может оставаться в норме в начальном периоде, а также быть высоким при состояниях, не связанных с ОП: макроамилазия, заболевания слюнных желез, у пациентов со сниженной клубочковой фильтрацией, не панкреатическими воспалительными заболеваниями органов брюшной полости: острый аппендицит, холецистит, острая кишечная непроходимость, язвенная болезнь, гинекологические заболевания [12]. Увеличение показателей липазы же начинается от 4 до 8 ч и достигает максимума в 24 ч, а возвращается к норме в течение 8–14 дней. Ей также свойственен подъем при не панкреатических патологиях: заболевания почек, острый аппендицит, холецистит, кишечная непроходимость и прочее [13].
В свою очередь КТ может не выявить изменений на начальном этапе, а газы в раздутом кишечнике могут маскировать очаговые гипоэхогенные зоны внутри поджелудочной железы [12]. А вот совместное применение лабораторных и инструментальных методов диагностики обеспечивает правильную постановку диагноза у 81–95 % пациентов [14].
После постановки диагноза нужно определить степень тяжести. Она подразделяется на легкую, среднюю и тяжелую.
Легкая характеризуется отсутствием признаков местных и общих осложнений. Она же и соответствует морфологической форме интерстициального отечного панкреатита.
Средняя степень ставится при признаках органной недостаточности, которая проходит в течение 48 ч, при наличии или отсутствии местных осложнений.
Признаки недостаточности:
- дыхательная система: Pao2 / FiO2 ≤ 300;
- сердечно-сосудистая система: систолическое артериальное давление < 90 мм рт. ст. (без инотропной поддержки), несмотря на инфузию жидкость, и/или рН < 7,3;
- почки: креатинин в крови ≥ 170 ммоль / л.
Местные осложнения:
- острое перипанкреатическое скопление жидкости;
- панкреатическая псевдокиста;
- быстро возникшая зона некроза;
- нарушение эвакуации из желудка, тромбоз селезеночной и воротной вен и некроз ободочной кишки.
Тяжелая ставится при стойких признаках органной недостаточности (более 48).
Средняя и тяжелая степень соответствует некротизирующему панкреатиту, который в свою очередь разделяется на [15]:
- панкреатический паренхиматозный некроз;
- перипанкреатический некроз;
- панкреатический паренхиматозный некроз в сочетании с перипанкреатическим некрозом.
Для определения морфологической формы ОП и выявления местных осложнений необходима лучевая диагностика, о которой мы расскажем подробнее.
Визуализация при ОП обычно необходима, когда клиническая ситуация неясна. При помощи лучевых методов исследования можно определить основную причину ОП, оценить осложнения и тяжесть заболевания, наблюдать динамику развития заболевания. Но важно понимать, что визуализация рекомендуются не всегда.
Когда прибегать к лучевым методам исследования [21]:
- УЗИ брюшной полости — для выявления и оценки камней желчного пузыря. Исследование необходимо выполнять пациентам, у которых впервые возникли подобные жалобы и нет выявленной патологии;
- в острой ситуации, если клиническая картина и уровни амилазы и липазы являются неоднозначными, следует провести КТ с контрастированием;
- также при значительном ухудшении состояния пациента (резкое падение уровня гемоглобина и гематокрита, тахикардии, гипотензии, резком изменении температуры или лейкоцитозе) рекомендуется КТ с контрастированием.
Отсроченная КТ с введением контраста (> 7–21 дней после появления симптомов) очень эффективна в оценке тяжести и дальнейшей тактике ведения больного.
Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) — при билиарном панкреатите в пределах первых 24 ч, а у пациентов с острым холангитом — срочная ЭРХПГ (< 24 ч).
Когда от лучевых методов стоит воздержаться:
- при яркой (и явной) клинике острого панкреатита;
- КТ в первые 72 ч не может достоверно установить тяжесть течения ОП. Потому визуализация не должна проводиться для прогнозирования тяжести ОП на ранних стадиях заболевания;
- рутинную КТ для первичной оценки проводить не следует, так как подавляющее большинство осложнений можно заподозрить по клиническим и биохимическим признакам;
- МР–холангиография и ЭРХПГ, как правило, не показана пациентам с легкой формой билиарного панкреатита без клинических признаков непроходимости общего желчного протока[21].
В случае идиопатического ОП, необходимо исключить билиарную этиологию с помощью двух ультразвуковых исследований брюшной полости, а при необходимости — с помощью РХПГ и/или эндоУЗИ. Все это проводится для того, чтобы предотвратить рецидив панкреатита.
Медицинская помощь при ОП зависит от этапа ее оказания.
1. Догоспитальный этап. Основная задача — доставить больного в стационар. До момента медицинской эвакуации больного правило «голод, холод и покой» — актуальнее всего. Стоит сказать, что первый пункт, голод, не лечебная манипуляция, а необходимая мера догоспитального этапа: голодание нужно для облегчения инструментальной диагностики в условиях стационара.
Если вы — работник скорой помощи, необходимо обеспечить периферический венозный доступ и начать инфузионную терапию.
2. Госпитальный этап. Основная задача — определиться с тактикой ведения и излечить больного.
Все начинается с определения степени тяжести. Больной с ОП легкой степени тяжести может лечиться на хирургическом отделении, а среднетяжелые пациенты проходят лечение в условиях отделения реанимации и интенсивной терапии.
Для оценки степени тяжести ОП и прогноза развития заболевания в Европе используется множество различных шкал: Ranson, BISAP, APACHE–II и другие. При значениях шкал Ranson ≥ 3, BISAP ≥ 2, APACHE–II ≥ 8, можно ставить ОП тяжелой степени тяжести [16].
Таблица 1 | Шкала для оценки тяжести ОП Ranson

Таблица 2 | Шкала BISAP (Bedside index of severity of acute pancreatitis)

Шкалой BISAP можно воспользоваться в случае, когда больной ОП уже наблюдается по этому заболеванию. BISAP поможет контролировать лечение и, в случае необходимости, перевести больного в ОРИТ.
Российские клинические рекомендации общества хирургов (РОХ) рекомендуют применять в практике оценочную шкалу, которая была разработана в НИИ скорой помощи имени И.И. Джанелидзе:
Таблица 3 | Шкала экспресс-оценки тяжести ОП НИИ СМП им. И.И. Джанелидзе

Лечение острого панкреатита можно рассматривать с позиции общего и частного. Сначала обсудим общие моменты.
Использование антибиотиков
Недавние исследования показали, что антибиотикопрофилактика больных с ОП не снижает показатели смертности. Потому рутинная антибиотикопрофилактика больше не показана всем пациентам с острым панкреатитом [17].
Антибактериальная терапия рекомендуются для лечения инфицированного тяжелого острого панкреатита. Однако диагностика инфицирования может быть затруднена из-за клинической картины, которая может быть схожа с другими инфекционными осложнениями или с воспалительной реакцией, вызванной ОП. В таком случае, для прогнозирования риска развития инфицированного панкреонекроза может помочь измерение уровня прокальцитонина в сыворотке крови.
Для лечения пациентов с инфицированным некрозом следует применять антибиотики, спектр действия которых включает как аэробные, так и анаэробные микроорганизмы.
Рутинное профилактическое применение противогрибковых препаратов не рекомендуется пациентам с инфицированным острым панкреонекрозом, хотя Candida spp. встречаются у больных с инфицированным панкреонекрозом и указывают на пациентов с более высоким риском летальности.
Как мы уже говорили ранее, в патогенезе ОП происходит обсеменация тканей желудочно-кишечного тракта путем транслокации бактерий из просвета кишечника, что обуславливает инфицирование микрофлорой именно пищеварительного тракта (E. coli, Bacteroides, Enterobacter, Klebsiella, S. faecalis, S. epidermidis и S. aureus) что обуславливает высокую эффективность карбапенемов, особенно имипенема/циластатина. Кроме того могут быть эффективными хинолоны, метронидазол и цефалоспорины в высоких дозах.
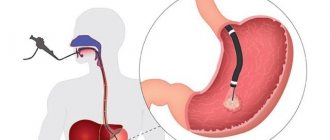
Методика ЭРХПГ
Совмещение эндоскопии с рентгеновским обследованием оптимально во всех отношениях: максимально возможная диагностика и доступность для осмотра «укромных уголков» при фиксации всего процесса выявления патологии на рентгеновском снимке и диске, что позволит последующее консультирование привлечёнными специалистами не в слепую, а по видео.
Первым этапом выполняется последовательная эндоскопия пищевода, желудка, двенадцатиперстной кишки. Далее по специальному каналу эндоскопа вводится катетер, кончик которого направляется в общий желчный проток, куда и подается контрастное вещество. Расположение контраста в анатомической зоне снимается на рентгеновскую пленку, а процесс движения эндоскопической аппаратуры фиксируется на видео. При обнаружении какого-либо новообразования внутри кишки или протока щипчиками берётся кусочек ткани — биопсия, если камень блокирует проток — тоже щипчиками крошится и удаляется. При сужении протока устанавливается стент или дренажный катетер.
Инфузионная терапия и анальгезия
Изотонические кристаллоиды являются предпочтительной жидкостью. Объем должен быть скорректирован с учетом возраста, веса пациента и ранее существовавших почечных и/или сердечных заболеваний. Гематокрит, азот мочевины, креатинин и лактат являются лабораторными маркерами волемии и адекватной перфузии тканей и должны контролироваться. Лактат Рингера может быть связан с противовоспалительным эффектом, но доказательства превосходства лактата Рингера по сравнению с изотоническим физиологическим раствором, основанные на рандомизированных исследованиях, выглядят неубедительными.
В качестве анальгетиков рекомендуется использовать нестероидные противовоспалительные препараты (НПВП). Однако от них необходимо отказаться при наличии у больного острого поражения почек (ОПП).
Эпидуральная анальгезия должна быть альтернативой или агонистом с внутривенной анальгезией. Контролируемая пациентом анальгезия (patient-controlled anaesthesia, PCA) должна быть интегрирована в стратегию лечения больного.
Дилаудид предпочтительнее морфина или фентанила у неинтубированного пациента.