Магнитно-резонансная томография (МРТ) головного и спинного мозга является основным методом диагностики, подтверждающим клинический диагноз рассеянного склероза (РС). Для подтверждения диагноза РС необходимо определение двух основных ключевых характеристик: диссеминации патологического процесса в пространстве и времени. Именно они легли в основу МРТ-критериев РС, которые появились еще в конце 80-х годов прошлого столетия и периодически пересматривались в связи с появлением новых знаний и результатов клинических исследований. Один из существенных пересмотров МРТ-критериев МакДоналда произошел в 2005 г. Данные критерии существовали вплоть до 2010 г., когда с целью упрощения и ускорения постановки диагноза для широкого применения были рекомендованы МРТ-критерии МакДоналда 2010 г.
Применение МРТ-критериев МакДоналда 2010 г.
В течение последних 30 лет неврологическим сообществом принимались различные диагностические критерии, которые каждый раз модифицировались после появления новых клинических данных [1—4]. Как известно, лечение любого заболевания наиболее эффективно на самой ранней его стадии, в связи с чем особенно важным является ранняя, быстрая и точная диагностика Р.С. Диагностические критерии РС в пересмотре 2010 г. основаны на выявлении поражения центральной нервной системы (ЦНС), которые демонстрируют диссеминацию патологического процесса в пространстве и времени. Кроме того, диагностические критерии требуют исключения других альтернативных диагнозов [5, 6]. Таким образом, с формальной точки зрения диагноз РС может быть поставлен только на основании клинических проявлений, но МРТ-исследование необходимо для подтверждения вышеописанных ключевых характеристик и исключения другой патологии ЦНС.
В 2010 г. Международная группа MAGNIMS (Magnetic Resonance Imaging in MS) представила пересмотр критериев МакДоналда (табл. 1). Этот вариант позволил увеличить чувствительность МРТ-критериев. Однако специфичность метода несколько снизилась по сравнению с более ранними пересмотрами от 2001 и 2005 гг. [3, 7]. В МРТ-критериях МакДоналда 2010 г. при оценке диссеминации патологического процесса в пространстве акцент ставится не на количестве очагов поражения, а на типичной их локализации, что облегчает интерпретацию МРТ. В них отсутствует также обязательный временной интервал между клинической атакой и первичным МРТ-исследованием, что способствует более раннему началу наблюдения за пациентом. Кроме этого учитывается сопутствующее наличие накапливающих и не накапливающих контрастное вещество (КВ) очагов как доказательство диссеминации патологического процесса во времени у некоторых пациентов, которым выполнено единственное МРТ-исследование в любое время после появления симптомов заболевания.
Таблица 1. МРТ-критерии МакДоналда 2010 г.
Ранее не существовало доказательств того, что нейровизуализационные характеристики больных ремиттирующим РС (РРС) существенно отличаются от таковых у больных первично-прогрессирующим РС (ППРС) [8]. В модифицированных критериях МакДоналда 2010 г. МРТ-критерии впервые были предложены отдельно как для диагностики ППРС, так и РРС (см. табл. 1) [3, 9]. Согласно данным критериям диссеминация патологического процесса в пространстве при ППРС определяется двумя из следующих трех критериев: наличие 1 очага и более в головном мозге в режимах Т2, по крайней мере в одной из трех типичных для РС локализаций (перивентрикулярно, юкстакортикально, субтенториально); наличие 2 очагов и более в режимах Т2 в спинном мозге; положительное исследование цереброспинальной жидкости (ЦСЖ) на олигоклональные антитела IgG.
Несмотря на преимущества МРТ-критерии МакДоналда 2010 г. вызвали критику. Было высказано мнение, что они могут поставить под угрозу диагностическую специфичность, приводя к гипердиагностике Р.С. Этот риск особенно велик, когда МРТ-находки анализируются без учета клинической и лабораторной информации или интерпретируются рентгенологами и клиницистами, которые не имеют необходимого достаточного опыта в оценке поражений головного и спинного мозга. Диагностические трудности обусловливает и отсутствие «неврологического» навыка у МРТ-специалиста, которому согласно МРТ-критериям 2010 г. необходимо дифференцировать симптомные и асимптомные очаги. При этом необходимо заметить, что проведение анализа ЦСЖ для подтверждения диагноза РРС по критериям МакДоналда 2010 г. не требуется, хотя соответствующие данные, несомненно, могут помочь некоторым пациентам [10].
Следует признать, что МРТ-критерии МакДоналда 2010 г. существенно улучшили процесс диагностики РРС, но они обладают рядом ограничений при ППРС [3]. В этих случаях МРТ как головного, так и спинного мозга, несмотря на улучшение современной аппаратуры, никаких особенностей и повреждений может не выявить [11]. Таким образом, диагностика ППРС может быть существенно затруднена.
Выше уже говорилось о том, что пересмотр МРТ-критериев МакДоналда в 2010 г. был частично основан на результатах работы группы MAGNIMS, исследовавших пациентов европеоидной расы [9, 12]. Существует мнение, что они могут быть применены для диагностики РС и у лиц азиатского, латиноамериканского происхождения, а также пациентов детского возраста [3]. В настоящее время уже опубликованы данные в отношении специфичности критериев МакДоналда у пациентов этой возрастной группы. В одном из таких исследований ретроспективно сравнивались МРТ-критерии МакДоналда 2005 и 2010 гг. в группе детей с острой демиелинизацией, которых затем проспективно наблюдали в течение последующих 24 мес [13]. Исследователи констатировали высокую чувствительность и специфичность МРТ-критериев МакДоналда 2010 г. у детей старше 11 лет, которые имели клинические симптомы, не связанные с острым рассеянным энцефаломиелитом (ОРЭМ). Результаты и выводы другого многоцентрового ретроспективного исследования [14] также подтвердили высокую диагностическую ценность МРТ-критериев МакДоналда 2010 г. у детей.
После выделения оптиконейромиелита Девика и оптиконейромиелит-ассоциированных синдромов точность МРТ-критериев МакДоналда 2010 г. у пациентов с клинически изолированным синдромом (КИС) стала сопоставимой между больными европеоидной и азиатской рас [15].
Применение МРТ-критериев РС 2021 г.
МРТ-критерии впервые были включены в диагностический алгоритм пациентов с КИС, у которых предполагался РС, в 2001 г., после чего подверглись нескольким пересмотрам. С момента их обновления в 2010 г. не только появились новые данные использования МРТ в оценке диссеминации процесса в пространстве и времени, но улучшилась также МРТ-аппаратура в виде более широкого внедрения в практику высокопольных томографов (1,5 и 3 Тл) и новых импульсных последовательностей. Все это послужило причиной последнего пересмотра МРТ-критериев РС группой MAGNIMS в 2021 г.
Указанные изменения отражены в табл. 2, из которой видно, что они коснулись критериев диссеминации патологического процесса в пространстве.

Таблица 2. МРТ-критерии MAGNIMS 2021 г. Примечание. Для удобства все изменения в табл. 2 относительно последнего пересмотра от 2010 г. подчеркнуты.
Учитывая, что наличие одного перивентрикулярного очага не является достаточно специфичным для демиелинизирующего воспалительного процесса и то, что очаги могут быть выявлены у здоровых и пациентов с другими неврологическими заболеваниями [16], были внесены изменения в количество перивентрикулярных очагов по сравнению с МРТ-критериями МакДоналда 2001 и 2005 гг. [1, 2]. Значение количества очагов было подтверждено в ряде исследований при анализе большой когорты из 652 пациентов с КИС, который показал, что у пациентов, не отвечающих критериям диссеминации патологического процесса в пространстве для РС, но имеющих три перивентрикулярных очага в сочетании с возрастом и наличием олигоклональных антител, наблюдается высокий риск развития РС [17]. В другом исследовании [18] у больных с КИС с вовлечением спинного мозга, в возрасте до 40 лет, с тремя перивентрикулярными очагами и более и синтезом интратекального иммуноглобулина наблюдается развитие РС с точностью до 78%. В многоцентровом исследовании 468 пациентов с КИС наличие 3 периветрикулярных очагов имело значимое прогностическое значение трансформации в РС в течение 3-летнего периода наблюдения [19]. В исследовании по сопоставлению пациентов с РС и первичным и вторичным васкулитами ЦНС наличие трех и более перивентрикулярных очагов было единственным признаком в МРТ-критериях, позволившим дифференцировать РС от системной красной волчанки или синдрома Шегрена [20].
В литературе привлекается также внимание к необходимости включения зрительного нерва в качестве дополнительной области ЦНС, типичной для РС, которая может вовлекаться в патологический процесс. Особенности визуализации клинически асимптомного воспаления зрительного нерва (очаги в нем на МРТ или истончение слоя нервных волокон сетчатки) подтверждают диссеминацию в пространстве и у пациентов без зрительных нарушений на данный момент — диссеминацию и во времени [8].
Результаты гистологических исследований показали, что при РС имеет место обширное вовлечение серого вещества в патологический процесс [21]. В соответствии с локализацией очагов в коре головного мозга выделяют следующие подтипы корковых очагов: субпиальные, чисто внутрикорковые и очаги, располагающиеся на границе коры и субкортикального белого вещества. Визуализация корковых очагов является достаточно сложной задачей, особенно при использовании стандартных МРТ-протоколов. Для улучшения чувствительности визуализации корковых очагов были предложены различные специальные импульсные последовательности, включая DIR, PSIR, MPRAGE [22]. Тем не менее многие кортикальные очаги остаются невидимыми на МРТ, даже на томографах с величиной магнитной индукции 1,5 и 3 Тл [23]. В связи с этим изменения в МРТ-критериях выразились не в выделении новой, корковой, локализации, а в расширении термина «юкстакортикальная локализация», которая теперь звучит как «юкстакортикально/кортикальная локализация». Оценка кортикальных очагов может также помочь в дифференциальной диагностике РС с другими заболеваниями, имитирующими РС (например, кортикальные очаги никогда не выявлялись при мигрени и оптиконейромиелите, а также очень редко встречались у здоровых пациентов) [21, 22].
В диагностических критериях МакДоналда 2010 г. для оценки диссеминации патологического процесса в пространстве не учитывались очаги, локализующиеся в стволе мозга и спинном мозге. В последнем пересмотре МРТ-критериев РС данное ограничение было снято и любые очаги теперь имеют равноценную диагностическую значимость. Для подтверждения диссеминации патологического процесса в пространстве рекомендуется визуализация всего спинного мозга (особенно у пациентов, которые не отвечают критериям диссеминации процесса в пространстве при МРТ-исследовании головного мозга).
Подразделение типов течения РС на РРС и ППРС, как известно, является сугубо клиническим. Тем не менее ведется поиск различных биомаркеров, с помощью которых можно было бы дополнительно различать эти клинические формы. В 2012 г. были опубликованы данные по исследованию чувствительности применения критериев поражения спинного мозга и исследования ЦСЖ на наличие олигоклональных антител [24]. В результате данного исследования критерий диссеминации патологического процесса в пространстве для спинного мозга в МРТ-критериях РС в пересмотре 2021 г. был изменен с 2 очагов и более на 1 очаг и более (при этом не важно, являются ли эти очаги клинически значимыми или нет), что существенно упростило данный критерий и повысило его чувствительность (см. табл. 2). Тем не менее требуется более детальная разработка критерия специфичности диссеминации патологического процесса.
МРТ-критерии, используемые для подтверждения диссеминации процесса в пространстве и во времени при РС, можно также применять и при радиологически изолированном синдроме (РИС) [25].
На сегодняшний день считается, что МРТ-критерии РС могут использоваться не только у лиц европеоидной расы, но и у пациентов из Азии и Латинской Америки [14, 26]. Но, к сожалению, пока отсутствуют работы, которые бы проанализировали применение МРТ-критериев РС у пациентов африканского и ближневосточного происхождения. У детей старше 11 лет, у которых исключен ОРЭМ, могут применяться МРТ-критерии диссеминации процесса в пространстве и времени, как у взрослых, но у детей младше 11 лет даже в случаях исключения у них ОРЭМ к их использованию нужно относиться более внимательно [13].
Гистологические и МРТ-данные показали, что диффузное (и необратимое) повреждение вещества мозга начинается на самых ранних стадиях РС. Своевременное выявление этих изменений может помочь определить пациентов с повышенным риском развития тяжелой инвалидизации. Стандартные методики МРТ, такие как режимы Т2 и режим Т1 после введения КВ, обладают высокой чувствительностью в визуализации очагов в белом веществе мозга. Тем не менее они недостаточно специфичны для определения характера изменений внутри очага и тем более они не имеют необходимой чувствительности для выявления диффузных изменений во внешне неизмененном сером и белом веществе головного и спинного мозга. В настоящее время основной задачей исследователей является изучение и внедрение передовых методик МРТ, направленных на выявление этих изменений.
Одной из таких передовых МРТ-методик является протонная МР-спектроскопия, которая проводилась у пациентов с КИС для определения характера изменений в веществе головного мозга помимо очагов демиелинизации, визуализируемых в режимах Т2. У пациентов с КИС во внешне не измененном белом веществе (ВНБВ) было обнаружено значительное снижение N-ацетиласпартата (маркер нейронального повреждения), а также увеличение миоинозитола (маркер повреждения глиальных клеток). Важно отметить, что уровень этих изменений был выше у тех пациентов, которым клинически впоследствии был поставлен диагноз РС [27]. Диффузионно-тензорная МРТ и изображения с феноменом переноса намагниченности также выявили различия в показателях во ВНБВ при сравнении пациентов с КИС и в контрольной группе. Это дает основание полагать, что эти методики могут иметь большое значение в прогнозировании когнитивных нарушений и инвалидности у таких пациентов [28, 29].
Несмотря на то что данные передовые МРТ-методики могут дать информацию для оценки риска развития РС, их чувствительность и специфичность для диагностики и дифференциальной диагностики у отдельных пациентов еще предстоит изучить. Они могут быть использованы для дифференциации РС от других демиелинизирующих заболеваний. Так, было показано, что при ОРЭМ, оптиконейромиелите Девика и оптической нейропатии Лебера наблюдаются менее диффузные изменения в веществе мозга, чем при типичном РС [30, 31]. Тем не менее требуются проспективные исследования с целью оценки преимуществ новых МРТ-методик перед стандартной МРТ в диагностике и прогнозе РС для быстрого принятия решения в отношении тактики лечения пациентов.
Накапливающие КВ очаги представляют собой новые активные на данный момент участки поражения, в то время как не накапливающие КВ очаги, визуализируемые в режимах Т2, являются более старыми очагами демиелинизации. В связи с этим критерии диссеминации патологического процесса во времени должны быть выполнены при условии обнаружения очагов с различным состоянием гематоэнцефалического барьера, вне зависимости от того, связаны они с настоящей клинической симптоматикой или нет [32].
«Черные дыры» — не накапливающие КВ гипоинтенсивные очаги в режиме Т1 представляют собой участки в веществе головного мозга с выраженной демиелинизацией и гибелью аксонов, и встречаются чаще всего у пациентов с большим стажем заболевания и прогрессирующими типами течения заболевания. Такие изменения в режиме Т1 необходимо также учитывать в МРТ-критериях. Таким образом, наличие «черных дыр» на МРТ у пациентов с КИС может указывать на не совсем благоприятное течение болезни. Однако следует отметить, что они не имеют прогностического значения в трансформации КИС в РС [33]. Наличие хронических «черных дыр» не используется как потенциальный альтернативный критерий диссеминации во времени у взрослых, однако наиболее оправдан у детей в дифференциации РС от монофазного заболевания (например ОРЭМ).
Признавая безусловную ценность метода МРТ в диагностике РС, следует все же обратить внимание врачей на то, что некоторые изменения на МРТ не являются специфическими для данного заболевания. В связи с этим нужно отметить, что МРТ-критерии МакДоналда последних пересмотров стали менее строгими и это, к сожалению, иногда может приводить к гипердиагностике Р.С. Поэтому столь актуальными в настоящее время в области применения МРТ являются вопросы дифференциальной диагностики.
Потенциальными мишенями для дифференциальной диагностики являются перивентрикулярная локализация очагов демиелинизации и предполагаемое увеличение отложения в них железа [34]. Эти признаки особенно видны на МРТ с высокой величиной магнитной индукции (≥3 Тл) [35]. Импульсная последовательность SWI (susceptibility-weighted imaging), впервые описанная в 2004 г. [36], показала высокую чувствительность в выявлении мелких вен головного мозга и обнаружении участков, содержащих железо, обладающих парамагнитными свойствами. Применение SWI дает дополнительную возможность для дифференциальной диагностики, особенно когда SWI выполняется и оценивается совместно с режимом FLAIR и носит название FLAIR* (см. рисунок) [37].
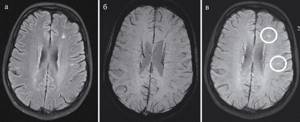
МРТ головного мозга пациента с РС в режимах FLAIR (слева), SWI (в центре) и их совмещение — FLAIR* (справа). Наблюдается перивенулярная локализация очагов демиелинизации во FLAIR* (веноцентрический паттерн).
Недавний опыт применения SWI на МРТ с величиной магнитной индукции 3—7 Тл показал, что большинство хронических и некоторые острые очаги демиелинизации при РС могут иметь участки с пониженной интенсивностью МР-сигнала. Эти гипоинтенсивные изменения, вероятно, представляют собой свободные радикалы или отложения железа, хотя потеря миелина также может вносить свой вклад в изменение интенсивности МР-сигнала на SWI [38].
Значительная часть (более 40%) очагов РС имеет в центральных отделах небольшую вену [39]. В недавнем исследовании с использованием режима 3D Т1 после введения КВ на МР-томографе с величиной магнитной индукции 3 Тл так называемый веноцентрический паттерн наблюдался в большинстве очагов РС и составил 95% [40]. Веноцентрическая локализация очагов и наличие в них гипоинтенсивных участков являются специфическими маркерами и должны использоваться в дифференциальной диагностике у пациентов с КИС или РС с другими неврологическими заболеваниями [41]. В связи с этим дальнейшие исследования должны быть направлены на изучение вышеописанных свойств SWI с целью увеличения специфичности МРТ в диагностике РС.
Еще одним направлением в дифференциальной диагностике РС является выявление изменений корковой локализации, которые напрямую связаны с когнитивными нарушениями. Кортикальные очаги встречаются в достаточном количестве у пациентов с РС и легко визуализируются в импульсной последовательности «двойной инверсии восстановления» — DIR (double inversion recovery), в которой происходит подавление интенсивности МР-сигнала от белого вещества и ЦСЖ [34]. Таким образом, DIR улучшает чувствительность МРТ для выявления очагов корковой локализации in
vivo
[42], но пока не позволяет различать между собой типы корковых очагов [22]. Более чувствительными в этом смысле являются последовательности PSIR (phase-sensitive inversion recovery) и MPRAGE (high-resolution 3D magnetization-prepared rapid acquisition with gradient echo), выполненные на аппаратах с высокими величинами магнитной индукции. Так, при совместном использовании этих последовательностей как минимум один кортикальный очаг обнаруживается у 36% пациентов с КИС, что соотносится с высоким риском трансформации его в клинически достоверный РС [43].
Повторные МРТ-исследования головного мозга необходимо выполнять пациентам, которые имеют клинические и рентгенологические данные, позволяющие предполагать РС, но пока еще не отвечают полностью МРТ-критериям Р.С. Временной интервал между первичным и последующим МРТ-сканированием является до сих пор предметом дискуссий, но считается, что оптимальный интервал должен составлять 3—6 мес. Это предположение основано на том, что у большинства (80%) пациентов с КИС, которые имеют по крайней мере три очага поражения в белом веществе при первичном МРТ-исследовании, в последующие 3 мес появляются новые очаги в режимах Т2 [44]. Если новые очаги поражения белого вещества при последующем МРТ отсутствуют, третье сканирование может быть выполнено через 6—12 мес. Эти временные интервалы могут также применяться у пациентов с РИС. Новые активные очаги, появляющиеся у пациентов с РИС при последующем МРТ-исследовании, значительно увеличивают риск развития у таких пациентов РС [45], хотя точный диагноз РС не может быть установлен при отсутствии соответствующей клинической симптоматики.
Основной целью повторных МРТ-исследований головного мозга является выявление активных очагов (т.е. новых или увеличенных в размере очагов в режимах Т2 с или без накопления КВ в режиме Т1). Важно, чтобы повторные МРТ-исследования были выполнены на том же оборудовании и по тому же стандартизированному МРТ-протоколу, как при первичном сканировании [46]. Адекватное репозиционирование также является необходимым для точной оценки сравниваемых последовательных МРТ-изображений и, наоборот, неправильное репозиционирование может приводить к артефактам, которые могут имитировать изменения при РС.
Таким образом, для постановки клинического диагноза РС важным в МРТ-диагностике является несколько составляющих: проведение МРТ-исследования квалифицированными специалистами с учетом использования стандартизированного МРТ-протокола, включающего введение КВ для выявления активных очагов и дифференциальной диагностики с другими заболеваниями, а также интерпретация результатов сканирования врачом-рентгенологом, имеющим достаточный опыт в анализе подобных изображений. Безусловно, даже при наличии многоочагового поражения головного мозга с характерной для РС МРТ-картиной необходимо сопоставлять МРТ-данные с неврологической симптоматикой и исключать другие альтернативные заболевания.
Авторы заявляют об отсутствии конфликта интересов.
Визуализация заболевания
Так как диагностическое исследование проводится посредством влияния на водород, содержащийся в теле, врачи знают, как выглядит рассеянный склероз на МРТ. Это возможно благодаря тому, что нервные клетки человека защищены слоем миелина: жировая структура, которая отталкивает воду. Такое заболевание как рассеянный склероз, разрушает жир, соответственно, незащищенные ткани подвержены накоплению излишней влаги. Именно вода отображается на изображении после сканирования и выглядит как тень или, наоборот, засвеченный участок (учитывается тип сканирования).
Особенности диагностики
Раньше диагностика рассеянного склероза происходила только клинически, по симптомам. Сегодня первоначальный диагноз требует подтверждения. Если врач ставит предварительное заключение, дается направление, чтобы узнать, что покажет магнитно-резонансная томография.