Описание
Синонимы (rus): Осмотическая стойкость эритроцитов, сфероцитоз, талласемия, гемолитическая анемия
Синонимы (eng): Osmotic fragility, spherocytosis,thalassemia, hemolytic anemia
Биоматериал: Венозная кровь
Показатель(и): Осмотическая стойкость эритроцитов
Метод(и): Осмотический лизис
Тип контейнера и особенности преаналитики: Пробирка для гематологических исследований с EDTA, 2 мл (фиолетовая крышечка). Тест на осмотическую стойкость эритроцитов выполняется в свежеприготовленной крови (в течение 2 часов после сбора), а также после инкубации при 37 ° С в течение 24 часов.
Тест на осмотическую стойкость эритроцитов используется для измерения устойчивости эритроцитов к гемолизу при воздействии разных концентраций солевого раствора. Когда эритроциты подвергаются воздействию гипотонической среды, вода попадает в клетку и приводит к ее лизису. Тест на осмотическую стойкость эритроцитов представляет собой классический тест для диагностики наследственного сфероцитоза. Сфероциты являются осмотически менее стойкими клетками, которые легче лизируются в гипотоническом растворе, по сравнению с нормальными эритроцитами. Классический осмотический тест на осмотическую стойкость, первоначально описанный Parpart et al. (1947), заключается в добавлении цельной крови в серию солевых растворов в диапазоне от 0,1% до 0,9%. Эти образцы подвергают центрифугированию с измерением оптической плотности при 540 нм, чтобы рассчитать процент гемолиза для каждого раствора.
Метод заготовки лейкофильтрованных отмытых эритроцитов
В.Н. Мельникова, Е.А. Селиванов, Г.Ю. Кирьянова, Т.А. Ефимова
Российский НИИ гематологии и трансфузиологии, г. Санкт-Петербург
Трансфузиология №3, 2010
Предложен метод заготовки эритроцитной среды, максимально лишенной примесей лейкоцитов, тромбоцитов и плазмы путем лейкодеплеции с помощью отечественного устройства-лейкофильтр УЛЛ-01 и последующего отмывания изотоническим раствором натрия хлорида, позволяющий повысить ее иммунологическую и инфекционную безопасность. Обоснована возможность хранения этой среды при 4°С в эритроконсерванте SAGM.
Ключевые слова: эритроциты, лейкодеплеция, отмывание, морфофункциональные свойства, безопасность.
Введение
Принцип гемокомпонентной терапии предусматривает использование для коррекции различных патологических состояний гемотрансфузионных сред, максимально очищенных от «балластных» элементов.
Цель трансфузий эритроцитсодержа-щих сред состоит в коррекции анемического синдрома, поэтому аллогенные лейкоциты — носители высокоиммуногенных антигенов (системы HLA и специфичных), не требующиеся для данной категории больных, могут стать причиной возникновения у них посттрансфузионных негемолитических температурных реакций, острой легочной недостаточности, вызвать аллоиммунизацию, рефрактерность к тромбоцитам, иммуносупрессию, а также стать источником лейкоцит-ассоциированных вирусных инфекций.
Кроме того, примесь лейкоцитов служит источником накопления в эритроцитных средах цитокинов и протеолитических ферментов, освобождающихся из быстро разрушающихся белых клеток и обладающих мембранотропным (гемолитическим) действием, что существенно ухудшает условия их хранения. Наличие в эритроцитной среде лейкоцитов и тромбоцитов служит основой формирования микросгустков.
Несмотря на то, что наиболее иммуногенной фракцией крови являются лейкоциты, наличие в эритроцитных средах плазмы также далеко не безразлично для больного. Несовместимость донора и реципиента по белкам плазмы проявляются аллергическими, анафилактоидными и анафилактическими осложнениями. Группу риска в этом отношении составляют пациенты с дефицитом IgA. В связи с вышеуказанным для снижения реактогенности и иммуногенности эритроцитных сред их подвергают дополнительной «очистке» с помощью отмывания или лейкофильтрации в тех случаях, когда они используются в программах трансфузионной терапии у гематологических больных, у пациентов с неблагоприятным трансфузиологическим и/или аллергологическим анамнезом, в детской и акушерской практике.
Однако недостатком взвеси отмытых эритроцитов даже при многократном отмывании является наличие в ней остаточных донорских лейкоцитов (не менее 30%) при отсутствии практически значимой примеси плазмы, а лейкофильтрованных эритроцитов — присутствие плазмы и в значительной мере тромбоцитов. Только сочетание этих двух методов позволяет получить эритроцитную среду, максимально очищенную как от белков плазмы, антител, цитокинов, тромбоцитов, так и от лейкоцитов и их фрагментов.
Целью настоящего исследования являлась разработка метода получения и изучение возможности консервирования эритроцитной среды, максимально обедненной другими компонентами крови. Учитывая результаты наших предшествующих исследований по созданию лейкофильтра и по отмыванию эритроцитов от плазмы, а также литературные данные, представлялось обоснованным на первом этапе заготовки новой среды проводить удаление лейкоцитов из эритроцитной массы (ЭМ), а на втором — отмывание красных клеток. При такой последовательности процедур создаются более благоприятные условия для задержки лейкоцитов при фильтровании (в присутствии плазмы) и возникает возможность исключить из технологии отмывания удаление лейкотромбослоя с подлежащим слоем эритроцитов, что уменьшает потерю красных клеток
Материалы и методы
Для фильтрования ЭМ использовали первое отечественное «Устройство-лейкофильтр для удаления лейкоцитов из консервированной крови и эритроцитных сред УЛЛ-01» производства ЗАО «НПП «Интероко» (ТУ 94444-031-17121966-99). Для заготовки лейкофильтрованных отмытых эритроцитов применение данного устройства является более целесообразным, чем использование нового отечественного лейкофильтра «Лейкосеп».
В соответствии с «Руководством по эксплуатации устройства» в контейнер с ЭМ, полученной из консервированной донорской крови 1-2 суток хранения (снятия лейкотромбослоя не требуется), вводили 50-100 мл изотонического раствора натрия хлорида и тщательно перемешивали с эритроцитной средой. Через фильтровальный узел пропускали промывную жидкость (изотонический раствор натрия хлорида) из соответствующей емкости в объеме около 150 мл, стараясь полностью вытеснить из корпуса фильтра воздух и промывая его. Затем корпус фильтра заполняли эритроцитной средой, вытесняя из него промывной раствор в стерильную емкость, которую затем удаляли.
Лейкофильтрацию выполняли со скоростью 44,7±7,67 мл/мин. Процедуру фильтрования заканчивали вытеснением остатков фильтруемой среды из корпуса лейкофильтра и фильтровального материала (пропуская 50 мл изотонического раствора натрия хлорида) в контейнер с профильтрованной средой. Затем последний герметизировали и отсоединяли.
Для отмывания лейкофильтрованных эритроцитов использовали специальный полимерный контейнер — «Контейнер для отмывания эритроцитов методом центрифугирования» (ТУ 64-2-419-90, АО медицинских препаратов и изделий «Синтез», г. Курган). Контейнер имеет емкость 500 мл, снабжен тремя полимерными трубками с иглами, предназначенными для присоединения к контейнеру с эритроцитной средой, подлежащей отмыванию, емкостям с отмывающим 0,9% раствором натрия хлорида и емкостям для слива надосадочной жидкости после каждого центрифугирования. Отмывание с центрифугированием в течение 20 минут при 2000 об/мин (1250 g) с охлаждением осуществляли двукратно. Надосадочную жидкость удаляли. Фильтрацию и отмывание эритроцитов производили в стерильных условиях в боксированном помещении. Контроль на бактериологическую контаминацию взвесей стабильно являлся отрицательным.
Для оценки эффективности описанной выше технологии нами изучены cодержание лейкоцитов в исходной ЭМ (в камере Горяева), остаточных лейкоцитов (в камере Nageotte) и остаточного белка плазмы в полученной эритровзвеси (c использованием реактива Ларионовой), а также потери эритроцитов в процессе лейкофильтрации и отмывания. Контролем служили отмытые эритроциты без предварительной лейкофильтрации.
Учитывая высокую актуальность наличия запасов максимально «чистой» эритроцитной среды для службы крови, в предыдущие годы нами разработан специальный эритроконсервант Модежель-глюфосфат, который позволяет хранить лейкофильтрованные отмытые эритроциты в течение 3-х недель. Однако производство препарата Модежель в период перестройки было прекращено и организация выпуска эритроконсерванта Модежель-глюфосфат в настоящее время невозможна по объективным причинам. В связи с этим нами изучена принципиальная возможность хранения при 4°С лейкофильтрованных отмытых красных клеток с использованием современного консерванта для нативных эритроцитов SAGM (10 серий экспериментов). В день заготовки эритроцитной среды и затем еженедельно определяли морфофункциональную полноценность взвесей эритроцитов, исследуя морфологию клеток в плазме (с расчетом морфологического индекса), содержание свободного гемоглобина, процент гемолиза клеток, содержание в них АТФ. Морфологический индекс рассчитывали как сумму произведений процентного содержания отдельных форм эритроцитов и соответствующих коэффициентов (оценивалось 100-200 клеток). Для дискоцитов использовался коэффициент 1,0; для тутовых форм — 0,6 и для сфероцитов — 0,0 (модификация метода Usry R.T.). Кроме того, исследовали процент осмотически неустойчивых клеток и деформируемость эритроцитов (фильтрационным методом при постоянном давлении).Содержание миелопероксидазы (МПО) и лактоферрина (ЛФ) в надстое взвесей отмытых эритроцитов определяли методом ИФА в ИЭМ АМН РФ (профессор В.Н. Кокряков).
Результаты и обсуждение
Предварительное добавление изотонического раствора натрия хлорида в ЭМ, его использование для промывания фильтровального материала и для вытеснения из лейкофильтра остатков среды после фильтрования, несомненно, способствуют эффективности дальнейшего отмывания профильтрованной среды от белков плазмы. Промывание устройства изотоническим раствором натрия хлорида до и после пропускания через него ЭМ не только не усложняет заготовку предлагаемой среды, но и обеспечивает уменьшение ее потерь (за счет вымывания эритроцитов из корпуса фильтра и соединительных трубок).
Результаты исследования содержания остаточных лейкоцитов и белков плазмы в опытной и контрольной сериях представлены в таблице 1.
Таблица 1
Содержание лейкоцитов и белков плазмы во взвесях эритроцитов
в опытной (профильтрованные отмытые) и контрольной (отмытые)
сериях экспериментов в день заготовки
| Серии исследований | Содержание лейкоцитов в исходной ЭМ | Удаление лейкоцитов, % | Содержание лейкоцитов в дозе взвеси | Содержание белка (г) в дозе взвеси |
| опыт | 5,5 ± 1,09×109/л | 99,96 ± 0,005 | 0,55±0,065×106 | 0,06 ± 0,035 |
| контроль | 9,2 ± 1,21×109/л | 69,02 ± 6,023 | 0,86±0,170×109 | 0,05 ± 0,028 |
Как видно из данных табл. 1, предложенная технология позволяет снизить содержание лейкоцитов на 99,96±0,005% по сравнению с исходной эритромассой. Остаточное количество белых клеток в дозе взвеси профильтрованных отмытых эритроцитов непосредственно после ее заготовки равнялось в среднем 0,55±0,065×106, что соответствует требованиям международных стандартов и обеспечивает надежную профилактику не только иммунологических негемолитических фебрильных реакций, но и аллоиммунизации, а также переноса инфекций, вызванных цитомегаловирусом, вирусом Эпштейна-Барр, снижает риск передачи вируса Т-клеточного лейкоза. В контрольных сериях в дозе взвеси содержание лейкоцитов оказалось на 3 порядка большим — в среднем 0,86±0,170×109.
Двукратное отмывание эритроцитов резко снизило содержание донорского белка в дозе взвесей как в опыте (0,06±0,035 г), так и в контроле (0,05±0,028 г), что на порядок меньше допустимой международными стандартами величины (0,5 г/доза). Поэтому профильтрованные и отмытые эритроциты можно переливать аллергизированным к белкам плазмы больным, IgA-дефицитным пациентам, а также страдающим комплементзависимыми анемиями.
Потери эритроцитов при использовании предложенного нами метода составили сравнительно небольшую величину. Они равнялись в опыте (при определении по снижению содержания гемоглобина) — 12,4±0,20%; в контроле этот показатель оказался несколько меньшим (т. к. отсутствовали потери в фильтрационном узле) — 9,1±0,96%. Однако даже в опытных сериях потери красных клеток приближались к показателю, допустимому при заготовке отмытых эритроцитных сред (10-15%). Такие потери компенсируются преимуществами полученной данным методом эритроцитной среды. Процент гемолиза в результате процедуры изменялся незначительно, содержание осмотически неустойчивых эритроцитов несколько снижалось. Уровень АТФ соответствовал исходному и равнялся 4,59±1,31 мкМоль/ г Hb.
Ранняя лейкодеплеция эритроцитных сред обеспечивает, по нашим данным, отсутствие нарастания при хранении эритровзвеси содержания продуктов распада лейкоцитов, в частности, миелоперок-сидазы и лактоферрина (табл. 2).
В серии профильтрованных отмытых эритроцитов в эритроконсерванте Модежель-глюфосфат исследованные нами ферменты практически отсутствовали в течение всего срока хранения. Лишь в одном из опытов на 21-е сутки было обнаружено крайне низкое содержание миелопероксидазы (23 нг/мл при норме 160±15 нг/мл) и лактоферрина (32 нг/мл при норме 1000±140 нг/мл). В то же время во взвесях отмытых эритроцитов, не подвергшихся лейкофильтрации, имело место нарастание концентрации МПО (с 42,7 нг/мл в первые сутки до 355,5 нг/мл к концу срока хранения) и ЛФ (в среднем, с 580,7 до 4242,5 нг/мл).
Таблица 2
Содержание МПО и ЛФ во взвесях профильтрованных отмытых эритроцитов
(опыт) и отмытых эритроцитов (контроль) в процессе хранения при 4°С
| Показатели | Опыт, сутки (n=4) | Контроль, сутки (n=4) |
| 1 14 21 | 1 14 21 | |
| Миелопероксидаза нг/мл (N = 160 ±15) | 0 ± 0,0 0 ± 0,0 5,8 ± 4,90 | 42,7 ±20,85 181,5 ± 94,32 355,5 ± 39,24 |
| Лактоферрин нг/мл (N = 1000 ±140) | 0 ± 0,0 0 ± 0,0 8,0 ± 6,90 | 580,7 ± 414,95 1412,5 ± 1054,60 4242,5 ± 714,20 |
Что касается содержания лактоферрина, то отмечалась значительная вариабельность результатов в разных опытах.
Так, через две недели хранения в контрольной серии опытов его концентрация колебалась от 0 до 5046 нг/мл. Более высокое содержание ферментов в конце срока хранения не профильтрованных взвесей можно объяснить как технологией отмывания в этих сериях опытов (без снятия лейкотромбослоя), что приводит к повышенному содержанию остаточных лейкоцитов во взвеси, так и удалением плазмы, в которой содержатся естественные ингибиторы протеолитических ферментов.
Для изучения возможности консервирования при 4°С лейкофильтрованных отмытых эритроцитов в растворе SAGM, предназначенном для нативных эритроцитов, было поставлено 10 серий исследований. Лейкофильтрацию и отмывание красных клеток осуществляли в соответствии с «Временной инструкцией по методу заготовки эритроцитной массы, максимально лишенной примесей лейкоцитов (путем фильтрования) и плазмы (путем отмывания)», одобренной решением Ученого совета РосНИИГТ.
По завершении лейкофильтрации и двукратного отмывания эритроцитов изотоническим раствором натрия хлорида, после удаления надосадочной жидкости, к красным клеткам опытной серии добавляли эритроконсервант SAGM (2:1). Полученные взвеси хранили при 4°С 21 сутки. Показатели, характеризующие морфофункциональные свойства взвесей эритроцитов в эритроконсерванте SAGM в процессе их хранения при 4°С приведены в табл. 3.
Представленные данные свидетельствуют, что к концу наблюдаемого срока хранения эритроцитов (21 день) уровень АТФ остается достаточно высоким — более 80% от исходного — за счет содержания в эритроконсерванте SAGM аденина. Однако в процессе хранения взвесей отмечено существенное (более чем в 5 раз к 21-м суткам) нарастание концентрации свободного гемоглобина и процента гемолиза красных клеток. Это не позволяет рекомендовать хранение взвесей профильтрованных отмытых эритроцитов в течение столь длительного времени, несмотря на то, что уровень гемолиза не достиг предельно допустимого значения (согласно международным стандартам — 0,8%), а ограничить этот срок одной неделей, что уже немаловажно для деятельности учреждений службы крови. Организация в перспективе производства эритроконсерванта Модежель-глюфосфат обеспечит возможность полноценного хранения лейкофильтрованных отмытых эритроцитов в течение 21-х суток..
Таблица 3
Морфофункциональные показатели взвесей профильтрованных
через лейкофильтр УЛЛ-01 «Интероко» и отмытых эритроцитов
в эритроконсерванте SAGM (n=10) в процессе хранения при 4°С
| Срок хранения, сутки | |
| Показатели | 1 7 14 21 |
| Морфологический индекс | 97,5±0,98 88,0±4,72 87,0±2,83 84,4±5,90 |
| Гематокрит, % | 50,9±1,17 52,6±1,32 52,4±0,93 52,8±0,73 |
| Свободный гемоглобин, г/л | 0,30±0,038 0,72±0,167 1,36±0,219 1,72±0,222 |
| Процент гемолиза | 0,09±0,009 0,21±0,043 0,41±0,060 0,51±0,071 |
| Содержание АТФ, мкМ/г Hb | 4,59±0,131 4,26±0,212 4,10±0,144 3,77±0,251 |
| АТФ, процент к исходному | 100,0 92 ,8±3,99 89,5±3,79 82,2±4,91 |
| ОНЭ, % | 0,9±0,58 1,6±0,43 4,2±0,83 7,7±2,59 |
| Деформируемость эритроцитов ИДЭ0 | 1,40± 0,508 1,21± 0,336 1,49± 0,378 1,80± 0,384 |
Заключение
Фильтрование эритромассы через отечественное устройство-лейкофильтр УЛЛ- 01 производства ЗАО «НПП «Интероко» с последующим двукратным отмыванием профильтрованных эритроцитов изотоническим раствором натрия хлорида позволяет снизить содержание лейкоцитов до уровня 0,55±0,065×106 и белка до 0,06±0,035 г в дозе. Заготовленную предложенным методом среду следует использовать в течение 24-х часов, как это предусмотрено действующей инструкцией для отмытых эритроцитов. Взвешивание в растворе SAGM позволит продлить срок ее хранения до 1 недели. Принимая во внимание это обстоятельство, представляется целесообразной организация производства полимерных контейнеров с раствором SAGM с учетом обоснованных в них потребностей.
Взвесь профильтрованных отмытых эритроцитов представляется оптимальным средством гемокомпонентной терапии для пациентов, сенсибилизированных не только к белкам плазмы, но и при наличии анти-HLA, специфичных антигранулоцитарных и антитромбоцитарных антител; трансфузионнозависимым больным с целью профилактики аллоиммунизации и острого поражения легких; иммуннокомпрометированным лицам для предупреждения переноса ряда вирусных инфекций; в педиатрии, в том числе в случае аллоиммунной тромбоцитопении новорожденных; больным с отягощенным акушерско-гинекологическим анамнезом (частые беременности, выкидыши); для профилактики синдромов «массивных гемотрансфузий» и «аллогенной крови»
Интерпретация
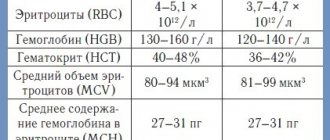
Пониженная осмотическая стойкость эритроцитов характерна для пациентов с наследственным сфероцитозом. Сфероциты являются осмотически менее стойкими клетками, которые легче лизируются в гипотоническом растворе, по сравнению с нормальными эритроцитами. Тест на осмотическую стойкость после инкубации цельной крови в термостате при t=37° С считается более чувствительным, чем тест на осмотическую стойкость эритроцитов без инкубации. Пониженная осмотическая стойкость также может наблюдаться при других заболеваниях, включая наследственный стоматоцитоз, наследственный пиропойкилоцитоз, врожденную дизэритропоэтическую анемию типа II. Данный феномен также может быть ассоциирован с аутоиммунной гемолитической анемией, отравлениями, ожогами, состояниями после гемотрансфузии. Повышенная осмотическая стойкость эритроцитов указывает на наличие сплющенных эритроцитов (лептоцитов), у которых снижено соотношение площади поверхности к объему. Такое изменение происходит при железодефицитной анемии, талассемии и серповидноклеточной анемии, так как эритроциты с низким содержанием гемоглобина (MCH) и низким средним объемом клеток (MCV) необычайно устойчивы к осмотическому лизису. Ретикулоциты и эритроциты у пациентов после спленэктомии также более осмотически устойчивые по сравнению с нормальными клетками. При заболеваниях печени вследствие пассивного накопления липидов эритроциты также более устойчивы к осмотическому лизису.