Исследование биоценоза урогенитального тракта у женщин (Фемофлор-16)
Фемофлор — уникальная технология, основанная на использовании полимеразной цепной реакции (ПЦР) «в режиме реального времени». Эта технология на сегодняшний день позволяет дать самую полную количественную и качественную характеристику нормальной и условно-патогенной флоры урогенитального тракта у женщин. Фемофлор позволяет проводить исследование труднокультивируемых анаэробных микроорганизмов и при этом обладает высокой чувствительностью и специфичностью.
Что такое биоценоз?
Биоценоз (от греч. βίος — «жизнь» и κοινός — «общий»), — это совокупность разных видов микроорганизмов, связанных между собой определенными отношениями и населяющими определенную биологическую нишу. В случае биоценоза влагалища биологической нишей для микроорганизмов является вагина. Микрофлора влагалища у женщин детородного возраста — хорошо сбалансированная, устойчивая система и может включать более ста видов различных бактериальных микроорганизмов, основными из которых являются лактобактерии, которые и составляют нормальную микрофлору. Лактобактерии вырабатывают перекись водорода, молочную кислоту, которая снижает рН влагалища до 4,0—4,5. Кислая реакция благоприятна для роста и размножения лактобактерий, но не других микроорганизмов. Известно, что молочнокислые бактерии стимулируют местный иммунитет. За счет этих факторов лактобактерии защищают мочеполовую систему женщины, препятствуют заселению влагалища патогенными микроорганизмами и чрезмерному размножению условно-патогенных бактерий. Кроме лактобактерий во влагалище могут присутствовать в незначительных количествах и другие микроорганизмы (гарднереллы, дрожжеподобные грибы, стрептококки, стафилококки и другие). Состав микроорганизмов, населяющих женский организм, в том числе мочеполовую систему, уникален для каждой женщины и зависит не только от возраста, но и образа жизни. Зная особенности состава микроорганизмов, можно вовремя заметить даже небольшие отклонения и ещё до появления неприятных симптомов скорректировать их минимальными усилиями, предупредив развитие заболевания.
Важно, что биоценоз влагалища участвует в обеспечении детородной функции женщины, защищая ее от возможных инфекционных процессов.

Нарушение баланса между нормальной микрофлорой и условно-патогенными микроорганизмами приводит к развитию дисбиоза. Дисбиотические нарушения вызывают целый ряд проблем — от незначительного дискомфорта, снижения качества жизни женщины до серьезных репродуктивных проблем. Причин развития дисбиотических процессов во влагалище существует достаточно много:
- изменения и нарушения гормонального фона (нерегулярная половая жизнь, беременность, роды, аборты, любые виды нарушений цикла, половое созревание, климакс, применение гормональных контрацептивных и лекарственных средств);
- применение внутриматочных спиралей;
- беспорядочная половая жизнь (пренебрежение средствами барьерной контрацепции, частая смена полового партнера);
- инфекции половых органов (инфекционно-воспалительные заболевания органов малого таза, инфекции, передающиеся половым путем);
- прием антибиотиков (длительный или повторные курсы);
- заболевания кишечника (хронические проблемы со стулом, дисбактериоз кишечника);
- нарушение правил личной гигиены (неправильное использование тампонов создаёт благоприятные условия для роста бактерий, частые спринцевания, использование для интимной гигиены косметических моющих средств, ношение тесного синтетического белья);
- снижение общего и местного иммунитета;
- переохлаждение организма; несбалансированное питание (нехватка витаминов и микроэлементов);
- стрессы и переутомления;
- смена климатической зоны.

Для чего проводтся исследование
Исследование проводят для определения наличия, степени и характера дисбаланса микрофлоры. Что, в свою очередь крайне важно для врача-клинициста при выборе тактики лечения и для контроля эффективности проведенного лечения.
Кому и когда показано данное исследование
Данное исследование проводят:
- если Вас беспокоят неприятные симптомы (зуд, жжение, выделения, ощущения дискомфорта в области половых органов);
- перед планируемым оперативным вмешательством в области малого таза;
- если имеется ощущение дискомфорта после приема гормональных препаратов, антибиотиков;
- бесплодие;
- невынашивание беременности;
- планирование беременности;
- подготовка к экстракорпоральному оплодотворению
- при неэффективном лечении, при неясных результатах других методов лабораторной диагностики.
Важно понимать, что нарушение баланса микрофлоры, влияющее на качество Вашей жизни, являются не только неудобными, но и могут привести к проблемам. Своевременная диагностика поможет выявить даже незначительные нарушения. Следовательно, при малейшем дискомфорте, не надо ждать долго, не откладывайте визит к врачу.
Исследование микробиоценоза влагалища с определением чувствительности к антибиотикам
Бактериологическое исследование полученного из влагалища материала, которое позволяет оценить количественный состав микрофлоры, соотношение микроорганизмов, выявить снижение количества лактобактерий, увеличение роста факультативных или появление атипичных микроорганизмов и определить их чувствительность к антибактериальным препаратам.
Синонимы русские
Посев на дисбиоз влагалища с чувствительностью к а/б, посев мазка из влагалища на бак. биоту и чувствительность к а/б.
Синонимы английские
Vaginal Culture with Antibiotic susceptibility testing.
Метод исследования
Микробиологический метод.
Какой биоматериал можно использовать для исследования?
Мазок урогенитальный.
Как правильно подготовиться к исследованию?
- Женщинам рекомендуется сдавать урогенитальный мазок до менструации или через 2-3 дня после ее окончания.
Общая информация об исследовании
Нормальная микрофлора влагалища благодаря стабильности количественного и видового состава препятствует заселению влагалища патогенными микроорганизмами и подавляет чрезмерное размножение условно-патогенных микроорганизмов (УПМ), входящих в небольшом количестве в нормальный микроценоз. Вагинальная микроэкосистема состоит из постоянно обитающих (облигатных) и транзиторных (случайных) микроорганизмов. Основными представителями нормальной микрофлоры влагалища являются:
- грамположительные облигатно-анаэробные и микроаэробные бактерии (лактобактерии, бифидобактерии, пептострептококки, клостридии, пропионобактерии, мобилункус),
- грамотрицательные облигатно-анаэробные бактерии (бактериоиды, превотеллы, порфиромонасы, фузобактерии, вейлонеллы),
- факультативно-анаэробные микроорганизмы (гарднереллы, коринебактерии, микоплазмы, стафило- и стрептококки, энтеробактерии, дрожжевые, грибы рода Candida).
В разные периоды жизни женщины в зависимости от активности репродуктивной функции и гормонального баланса микроценоз влагалища имеет определенные особенности. До первой менструации и становления менструальной функции на фоне нефункционирующих яичников в составе микрофлоры влагалища преобладают грамположительные кокки – эпидермальный и другие коагулазоотрицательные стафилококки, микрококки, негемолитический стрептококк. Реже встречаются непатогенные нейссерии и коринебактерии, еще реже – эшерихии и энтерококки. По мере полового созревания увеличивается количество лактобацилл, и у половозрелых девочек микрофлора практически полностью представлена лактобациллами.
У здоровых женщин репродуктивного возраста общее количество микроорганизмов в вагинальном отделяемом составляет 107-109 КОЕ/мл (колониеобразующих единиц на миллилитр) и состоит из более чем 40 разнообразных видов. Преобладают палочки Додерляйна – Lactobacillus spp. (95-98 %) — большая группа бактерий, в основном микроаэрофилов. Несмотря на разнообразие видового состава лактобацилл, выделяемых из влагалища здоровых женщин (более 10 видов), не удается определить ни одного вида, который присутствовал бы у всех женщин. Чаще всего удается выделить следующие лактобациллы: L. acidophilus, L. brevis, L. jensenii, L. casei, L. leishmanii, L. Plantarum. Среди транзиторных микроорганизмов влагалища наиболее распространены коагулазоотрицательные стафилококки, в первую очередь S. epidermidis, Corynebacterium spp., Streptococcus spp., Bacteroides, Prevotella spp., Mycoplasma hominis, которые обычно присутствуют в умеренном количестве (до 104 КОЕ/г). Столь же часто, но в меньшем количестве встречаются Micrococcus spp., Propionibacterium spp., Veillonella spp., Eubacterium spp. Среди сравнительно редко встречающихся микроорганизмов (менее чем у 10 % обследованных) обнаруживаются Clostridium spp., Bifidobacterium spp., Actinomyces spp., Fusobacterium spp., Ureaplasma urealyticum, Staphylococcus aureus, Neisseria spp., E. coli и другие колиформные бактерии, Mycoplasma fermentans, Gardnerella vaginalis, Candida spp.
Снижение количества лактобактерий и избыточный рост условно-патогенных микроорганизмов приводит к дисбиотическим нарушениям, которые могут клинически проявиться воспалением стенок влагалища – вагинитом, сопровождающимся выраженным зудом, жжением, аномальными выделениями. Патологические изменения в вагинальном микроценозе могут возникнуть при лечении антибиотиками (местном или системном), цитостатиками, гормонами, проведении лучевой терапии, особенно на фоне эндокринопатий (в первую очередь при диабете), при анемии, врождённых пороках развития половых органов, при использовании контрацептивов и нарушениях в иммунной системе.
Исследование микробиоценоза влагалища (бакпосев) помогает диагностировать дисбиоз (бактериальный вагиноз), выявить возбудителя неспецифического бактериального вагинита, грибковой инфекции, воспалительного заболевания органов малого таза или инфекций, передающихся половым путем.
Данный метод исследования основан на способности микроорганизмов размножаться на искусственных питательных средах, что позволяет выявить виды бактерий и грибов, обитающих на слизистой, определить их концентрацию и чувствительность к антибактериальным препаратам. При выявлении вероятного возбудителя инфекционно-воспалительного процесса его инкубируют с антибиотиками или используют диффузионные диски, пропитанные лекарством – препаратом, к которому чувствителен выделенный микроорганизм, – это препятствует росту бактерий.
Бактериологический метод незаменим при инфекциях, вызванных условно-патогенными микроорганизмами (урогенитальными микоплазмами, дрожжевыми грибами, Entrobacteriaceae, Streptococcus spp., Staphylococcus spp. и др.), так как только с его помощью можно оценить количество возбудителя. Определение чувствительности к антибактериальным препаратам позволяет избежать назначения бесполезных, но небезопасных препаратов и подобрать адекватную терапию.
Для чего используется исследование?
- Для диагностики дисбиотических нарушений состава влагалищной микрофлоры;
- для выявления микроорганизма, вызвавшего развитие инфекционно-воспалительного процесса влагалища и органов малого таза;
- для определения препаратов, к которым чувствителен возбудитель инфекционно-воспалительного процесса (для подбора эффективной антибактериальной терапии);
- для диагностики неспецифического бактериального вагинита/вульвовагинита, бактериального вагиноза, кандидозного вульвовагинита.
Когда назначается исследование?
- При клинических признаках воспалительных заболеваний влагалища и органов малого таза (зуд, жжение, бели);
- при выявлении инфекционно-воспалительных изменений при микроскопии мазка из влагалища;
- при неэффективности лечения вагинита;
- при подборе антибактериальных препаратов для лечения воспалительных заболеваний.
Что означают результаты?
Результат интерпретируется лечащим врачом с учетом жалоб пациентки, анамнеза, клинических проявлений заболевания и исключения инфекций, передающихся половым путем.
Чувствительность к антибиотикам определяется при выявлении диагностически значимого роста условно-патогенной биоты.
В норме в посеве преобладают лактобациллы, условно-патогенные микроорганизмы отсутствуют или выявляются в небольшом количестве – менее 104.
При бактериальном вагинозе рост лактобацилл резко снижен или отсутствует, увеличено количество условно-патогенных микроорганизмов. При посеве могут быть выделены анаэробные микроорганизмы, Gardnerella vaginalis, Mycoplasma hominis, Mobiluncus spp., Bacteroides spp., пептострептококки.
При кандидозном вульвовагините на фоне снижения количества лактобактерий наблюдается рост Candida spp. более 104. При данной патологии при микроскопии материала должен выявляться псевдомицелий гриба.
Неспецифический бактериальный вулвовагинит характеризуется ростом одного или нескольких условно-патогенных микроорганизмов в диагностически значимом титре при снижении количества или отсутствии лактобацилл в посеве.
Важные замечания
- Исследование рекомендовано сочетать с микроскопией отделяемого из половых органов, окрашенного по Граму. При клинических признаках инфекционно-воспалительных заболеваний половых органов необходимо в первую очередь исключать инфекции, передающиеся половым путем.
- Следует помнить, что все условно-патогенные микроорганизмы могут встречаться и у здоровых женщин и проявляют свои патогенные свойства только при значительной концентрации. Результаты исследования должны интерпретироваться с учетом симптомов заболевания и жалоб пациентки.
Также рекомендуется
- Микроскопическое исследование отделяемого мочеполовых органов женщин (микрофлора), 3 локализации
- Анализ микробиоценоза влагалища. 16 показателей, ДНК количественно [реал-тайм ПЦР]
- Анализ микробиоценоза влагалища. 8 показателей, ДНК количественно [реал-тайм ПЦР]
- Посев на Gardnerella vaginalis с определением титра и чувствительности к противомикробным препаратам
- Neisseria gonorrhoeae, ДНК [реал-тайм ПЦР]
- Trichomonas vaginalis, ДНК [реал-тайм ПЦР]
- Ureaplasma species, ДНК количественно [реал-тайм ПЦР]
- Посев на Ureaplasma urealyticum с определением чувствительности к антибиотикам (при титре 1х10^4 и выше)
- Chlamydia trachomatis, ДНК [реал-тайм ПЦР]
- Посев на Chlamydia trachomatis с определением чувствительности к антибиотикам
Кто назначает исследование?
Акушер-гинеколог.
Литература
- Daniels R. Delmar’s Guide to Laboratory and Diagnostics Tests // Cengage Learning – 2009 – 1003 p.
- Larsen B., Monif G. Understanding the bacterial flora of the female genital tract. // Clin Infect Dis. – 2001 – 32 (4) – p.69-77.
- Инфекции в акушерстве и гинекологии/ Под ред. О. В. Макарова, В. А. Алешкина, Т. Н. Савченко. – М.: МЕДпресс-информ, 2007. – 464 с.
Биоценоз влагалища и противомикробная терапия.
- Коржуев С.И.
- Ноя, 08, 2012
- Для врачей
- Комментарии к записи Биоценоз влагалища и противомикробная терапия. отключены
Что происходит
В1996 г. комиссия Минздрава РФ констатировала факт эпидемического распространения инфекций, передаваемых половым путём. И с тех пор заболеваемость лишь продолжает расти. Во многом такую ситуацию можно объяснить ранним началом половой жизни, отсутствием элементарных знаний о безопасном сексе и интимной гигиене, определённой свободой сексуальных отношений и многочисленными случайными и спонтанными половыми контактами.
Число женщин с инфекциями, передаваемыми половым путём (гонорея, трихомониаз, хламидийная, сифилис, герпетическая, ВИЧ-инфекция, вирусный гепатит С), по сравнению с поколением их матерей на сегодняшний день возросло в 4 раза. И на этом фоне инфекционные заболевания половой сферы всё чаще возникают в результате активизации условно-патогенных инфектов.
Мероприятия, столь эффективные при классических инфекциях, для лечения заболеваний, вызванных условно-патогенной микрофлорой, оказались малопригодными. И сегодня условно-патогенные бактерии (клебсиелла, протей, кишечная палочка, энтерококки, полирезистентные штаммы условно-патогенных бактерий — облигатных анаэробов, микробные ассоциации) составляют очевидную конкуренцию возбудителям сексуально-трансмиссивных заболеваний. В спектре инфекций стали преобладать заболевания половых органов, развивающиеся на фоне дисбиоза.
В чём причина
Подобные сдвиги кажутся неожиданными лишь на первый взгляд. Предсказуемость этой ситуации — в отсутствии оздоровления подростков (у 63% из них ранний сексуальный дебют сопровождается дефлорационным циститом), в высокой частоте хронических общесоматических заболеваний (нарушающих иммунорезистентность), большинство которых к наступлению беременности так и остаются нераспознанными.
Свой вклад вносит аборт — единственный бесплатный в системе ОМС метод регулирования рождаемости, противоестественный по своей сути, ломающий все противоинфекционные барьеры, данные женщине природой. Кульминацией уничтожения естественной микрофлоры в отсутствие периабортной санации становится асептический или гнойный (почти 15%!) эндомиометрит.
Каковы последствия
Последствия предгравидарного дефицита лактобактерий после гинекологических воспалительных заболеваний и оперативных вмешательств ожидаемы и печальны. Желанная беременность в последующем может и не наступить. А если и происходит такое чудо, то крайне велик риск осложнений — неразвивающейся беременности, её самопроизвольного прерывания, длительной угрозы и рождения маловесного инфицированного внутриутробно ребёнка. У такого ребёнка после рождения нарушается соматический статус, снижается качество жизни.
Если представить эти потери в государственном масштабе, то немудрено, что мы на пороге демографической катастрофы — малочисленную рождаемость дополняет высокий индекс заболеваемости и болезненности.
А начинается всё с того, что молодые женщины не хотят, а врачи не настаивают на банальной предгравидарной подготовке и не корригируют биоценоз во время беременности.
Общий план коррекции биоценоза
Коррекция вагинальной микрофлоры в предгравидарный период немыслима без соблюдения основных постулатов — устранения дефицита гликогена (питательной среды для лактобактерий), т.е. восстановления двухфазного менструального цикла, а также восстановления полноценной промежности.
В целом комплекс средств для восстановления нормобиоценоза включает следующие пункты.
- Элиминация патогенных бактерий.
- Восстановление анатомо-функциональной полноценности промежности.
- Ликвидация запоров (что обеспечивает прирост лактобактерий во влагалище в 3 раза).
- Диета: квашеная капуста, йогурт, биокефиры.
- Эубиотики, восстановление кислотности влагалищной среды с помощью аскорбиновой кислоты.
- Гормональная регуляция менструального цикла с помощью КОК, гестагенов.
- Фитоэстрогены
Наиболее важным условием для коррекции любых форм дисбиоза следует считать восстановление нормальной архитектоники промежности, влагалища, шейки матки: устранение «зияющей» половой щели после родов.
К сожалению, отношение пациенток, равно как и врачей к этому вопросу крайне легкомысленно, вопреки установкам современной репродуктологии: истечение вагинального секрета делает поддержание нормобиоценоза невозможным.
Коррекция эстроген-дефицитных состояний необходима для сохранения определённого эстроген-прогестеронового градиента, так как именно благодаря достаточному количеству эстрогенов достигается необходимый уровень гликогена влагалища, при расщеплении которого лактобациллами до молочной кислоты и перекиси водорода обеспечивается гибель до 90% инфектов.
С этих позиций обосновано использование не только натуральных эстроген-гестагенных препаратов — Фемостона, современных КОК, но и фитоэстрогенов (сои, цимицифуги и красного клевера).
Остроумным способом является «подкисление» влагалищной среды обычной аскорбиновой кислотой в форме вагинальных таблеток (Вагинорм-С). Это приводит к препятствию размножения анаэробных бактерий и приросту лактобацилл до фактического нормобиоценоза.
«Лечение анализов»
Субъективными причинами увеличения дисбиотических и инфекционно-воспалительных заболеваний гениталий следует с сожалением признать две:
- нерациональное, зачастую необоснованное противомикробное лечение несуществующих заболеваний — из-за неправильной трактовки результатов лабораторных исследований врачами, в частности качественной ПЦР, а также
- самолечение различными безрецептурными и даже рецептурными препаратами с антимикробным действием.
К сожалению, зачастую мы лечим то, что лечить не следует, и наоборот. Происходит это по вполне заурядным причинам: мы привыкли доверять анализам, коих, если не следовать здравому смыслу, назначается беременной женщине огромное количество. Явно переоценивается информативность качественной ПЦР — наиболее популярного в женских консультациях исследования. Результатом этого недешёвого метода является определение инфекта в любом титре, в том числе в меньшем, чем он имеет право быть в норме.
Диагностика урогенитальных инфекций методом качественной ПЦР в России выполняется в 6 раз чаще, чем в США. Именно поэтому многочисленны так называемые «-озы» (микоплазмоз, уреаплазмоз, гарднереллёз) — исключительно отечественный «продукт» (в МКБ-10 отсутствуют как таковые!). В США, дабы пресечь стремление «лечить анализы», а также по причине «дороговизны и сверхинформативности» с 1 января2007 г. сочли нецелесообразным назначение даже бактериоскопического (!) исследования выделений беременных без жалоб на патологические бели.
Поразительно, что при всём стремлении «лечить во благо» повторный скрининг на инфекции после так называемой «санации» проводят лишь у 4% пациенток! Из «пролеченных» женщин 96% не подвергаются контрольному обследованию и, следовательно, никакого восстановления нормоценоза влагалища не проводится.
Нерациональная антибиотикотерапия
Антибиотикотерапию, ставшую столь привычной при выявлении любых симбионтов лишь недавно и далеко не везде, наконец-то начали анализировать с точки зрения последствий этих столь необдуманных «агрессивных» врачебных воздействий.
Глобальность последствий порочной тактики «больше анализов → больше лечения → извращение естественного биоценоза» подтверждает заключение, сделанное в рамках саммита глав «большой восьмёрки», на сателлитном симпозиуме министров здравоохранения в Санкт-Петербурге в 2007 г.
По обоюдному согласию министров было выделено $2 млрд на создание вакцины против пневмонии. Тем самым все остальные пути и попытки создания новых антибиотиков против пневмококков признаны бесперспективными — слишком много назначалось их по показаниям и без, а в результате — абсолютная антибиотикорезистентность пневмококков. По сути это начало конца эры антибиотиков.
Акушеры-гинекологи по частоте и бессмысленности назначения дезинфектантов и антибактериальных средств — в абсолютных лидерах.
А что должно быть в норме?
Одна из причин агрессивной химической атаки, следующей после абсолютно ненужного забора многочисленных анализов и нацеленной на стерильность (!) влагалища, — устаревшие воззрения на биоценоз, количественный и качественный состав вагинальной микрофлоры.
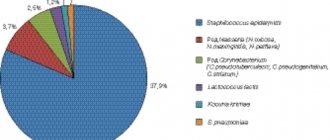
Доминанту лактобацилл, некогда бывших единственными представителями влагалищного биотопа, сменило провозглашённое всеми европейскими сообществами акушерства и гинекологии бактериальное разнообразие: у каждой второй здоровой женщины репродуктивного возраста в содержимом влагалища можно выделить гарднереллы, каждой четвёртой — кишечную палочку, каждой пятой — микоплазмы. Присутствие неэубиотичных вагинальной микрофлоре бифидобактерий возможно и без формирования вагинитов и вагинозов.
В отсутствие клинических проявлений и бактериоскопически обозначенного гноетечения допустимо присутствие Candida, что и имеет место у 25% небеременных и 50% беременных. Существование клостридий, коринебактерий, энтерококков, мобилункус, пептострептококков, превотеллы, кишечной палочки также возможно, если КОЕ указанных возбудителей не превышает 105, а КОЕ лактобактерий составляет более 107, и при этом отсутствуют клинические признаки воспаления. Женщина в этом случае — здорова и ни в каком лечении не нуждается.
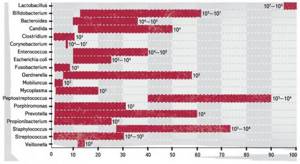
Частота выделения микроорганизмов из влагалища здоровых женщин репродуктивного возраста (%).
Количественные исследования микрофлоры влагалища показали: общее число бактерий во влагалище в нормальной вагинальной экосистеме не превышает 105–106 КОЕ/мл выделений, тогда как при бактериальном вагинозе возрастает до 109–1011 КОЕ/мл, при кольпитах — до 1012–1014 КОЕ/мл выделений.
Лечить или не лечить?
Причинами радикального отличия современного влагалищного микробиоценоза от излагаемого в учебниках 15–20-летней давности является изменение образа жизни женщин. Джинсовая мода, «джинсовые» тазы, колготки вместо чулок, средства менструальной гигиены (тампоны, прокладки, особенно ежедневные) привели к нарушению аэрации и увеличению анаэробного компонента в микробных ассоциациях.
Однако относиться к этим изменениям следует с позиций приятия данного микробного сообщества как должного, пресекая неразумные попытки добиться полной стерильности влагалища. Это невозможно в принципе!
Именно поэтому актуальной в проблеме инфекций урогенитального тракта остаётся достоверная дифференциальная диагностика носительства, бактериального вагиноза и действительно воспалительных заболеваний — вагинитов, цервицитов как реализованных инфекционно-воспалительных заболеваний. Остроту вопроса «Лечить или не лечить?» как нельзя лучше подчёркивает возросшее количество клинических разборов и даже судебных исков по поводу неадкватной антибиотикотерапии.
Если лечить бездумно
Практика показывает, что усиленная санация влагалища проводится на фоне даже I–II степени чистоты влагалища, к тому же по результатам неинформативных анализов — качественной ПЦР и бактериологического исследования («посев») без определения количественных характеристик.
Необоснованное лечение дезинфектантами, мощными антибиотиками, к тому же без определения чувствительности микрофлоры, осуществляется у 90% женщин, обследованных на урогенитальную инфекцию методом качественной ПЦР.
В бессмысленности и небезопасности такого «лечения» убеждают сведения по одной женской консультации, в которой из 440 беременных у 29% в I триместре была выявлена та или иная урогенитальная инфекция. Парадоксально, но титр лактобактерий у 24% женщин, отказавшихся от проведения антибактериальной терапии по разным причинам (тяжёлое материальное положение, идеологические убеждения), оказался выше в сравнении с когортой пролеченных по стандартным схемам.
Извращение биоценоза. Врачебная активность в отсутствие клинических проявлений у пациентки неминуемо ведёт к уничтожению всей микрофлоры и созданию непредусмотренного природой «пустого места», заселяемого вскоре теми же или аналогичными микробами, но с уже повышенной антибактериальной резистентностью, т.е. фактически — к извращению естественного биоценоза.
Реализация негативных последствий использования хлоргексидина происходит по истечении уже 2–3 ч: в 95% обнаруживается не «стерильный» результат, а условно-патогенная микрофлора, в 50% — патогеннее изначальной. Агрессивность традиционной санации демонстрировала частота вагинального кандидоза — у «пролеченных» таковой встречался в 2 раза чаще.
Родовой травматизм. В диссонанс устойчивым представлениям взаимосвязи разрывов промежности и шейки матки с крупной головкой и высокой промежностью, предрешает исход именно состояние тканей — выраженность травм тазового дна коррелирует с ухудшением вагинальной флоры (Марилова Н., 2007).
Более 100% аномальных биоценозов выявлялись у наиболее травмированных женщин: III и IV степени чистоты влагалища перед первыми родами были представлены в 47,1 и 39,5%, соответственно, а в 15,9% клинически был диагностирован кандидоз. Меньшая частота разрывов соответствовала ограниченному количеству случаев вагинитов (13,2%).
Вывод прост — нарушение биоценоза влагалища перед родами, реализовавшееся в бактериальный вагиноз и вагинит, повышает риск травмы промежности — рвётся только там, где есть III–IV степень чистоты.
К сожалению, стремление к малым разрезам при выполнении эпизио-, перинеотомии, приводит к дальнейшему продолжению раны, но уже в виде рваной — в 63% случаев. Но и эта страшная цифра увеличивается на 20% в условиях извращённого, как правило ятрогенно, биоценоза.
В продолжение порочного круга — отсутствие хирургической коррекции пролапсов предопределяет невозможность восстановления нормобиоценоза, что, как правило, и имеет место в большинстве случаев.
Послеродовые инфекционные осложнения. Страшная суть порочного круга, порождаемого назначением антибиотиков при носительстве и бактериальном вагинозе без последующего восстановления микрофлоры — в возрастании не только послеродового травматизма, но и послеродовых инфекционных заболеваний.
Реализация послеродового эндометрита и субинволюции матки как завуалированной формы эндометрита в 2 и в 1,5 раза чаще регистрируется на фоне агрессивной антибиотикотерапии. У нелеченных частота развития послеродовых гнойно-септических заболеваний не превышала таковую в популяции.
Резюмируя сведения о попытках добиться стерильности не только во влагалище, но и в роддоме, следует заметить критично: в соответствии с приказом Госсанэпиднадзора от2000 г. мы имеем право на существование госпитальной инфекции. При этом главное условие эффективности борьбы с ней — знание и мониторирование инфектов, инфекционный контроль.
Материнская смертность. Следствием необоснованной «химической» атаки на вагинальную микрофлору является не только формирование очень трудно излечимого состояния, но и крайне серьёзный момент, связанный с анализом показателей материнской смертности (2007).
Так, 2/3 умерших от аборта (13,2%) + 13,4% от послеродового сепсиса (в сумме 26,6%) составляют абсолютное первое место в структуре материнской смертности. Антибиотикотерапия становится нерезультативной, иммуноглобулины улучшают исходы, но не решают проблему.
Ятрогенные дисбиозы следует рассматривать как одну из управляемых причин материнской смертности от сепсиса.
Рациональная диагностика
Логически верным на пути к решению этой проблемы будет диагностирование вагинальной микрофлоры: в настоящее время следует ориентироваться на бактериоскопические данные, на количество лактобацилл и, если с этим всё в порядке, если у здоровой женщины нет III–IV степени чистоты влагалища, то никаким ПЦР-исследованиям её подвергать не надо.
Качественная ПЦР информативна только для обнаружения микроорганизмов, которых никогда не должно быть во влагалище (бледной трепонемы, гонококков, хламидий, трихомонад).
Следует сделать акцент на том, что качественная ПЦР не заменяет бактериологического исследования.
Тут нужно обратить внимание на ряд нюансов: до 70% трихомонад традиционными методами не диагностируется, и редко когда врач-лаборант возьмёт на себя смелость поставить диагноз по сухому мазку спустя несколько часов, когда отпали жгутики. Эффективен лишь метод «висячей капли». В противном случае способность трихомонад «консервировать» гонококки и хламидии (Д.В. Рюмин, 2002) оборачивается развитием «рецидивирующих» урогенитальных инфекций и необходимостью всё большего числа и дозы антибиотиков и, соответственно, стойким микотическим поражением.
При «воспалительном» мазке поиск инфекта проводится методом количественной ПЦР (соотношение колоний инфекта и лактобактерий) при использовании диагностического мультипраймерного набора для определения нуклеотидных последовательностей Lactobacillus spp. (558 н.п.) и Gardnerella vaginalis (820 н.п.) и бактериологически (посев из цервикального канала на микрофлору и чувствительность к антибиотикам).
При сомнениях «лечить или не лечить» рекомендуем придерживаться следующей врачебной тактики: если КОЕ этих возбудителей (Е. coli, St. epidermidis, St. aureus, Streptococcus группы B, Enterococcus faecalis, Enterobacter cloaceae,Klebsiella pneumoniae, Proteus mirabilis) не превышает 105, а КОЕ лактобактерий составляет более 107 в отсутствие клинических проявлений воспаления, женщина считается здоровой. Логичнее будет попытка восстановить биоценоз.
Трихомониаз
Согласно современным рекомендациям Американского центра по контролю предупреждения заболеваний (CDC), метронидазол является единственным препаратом выбора для лечения трихомонадной инфекции, который следует назначать внутрь либо по2 годнократно, либо по 500 мг 2 раза в день в течение 7 сут. Эти режимы лечения обеспечивают выздоровление в 90–95% случаев. Однако в I триместре беременности в период органогенеза и плацентации лечение процистоцидными препаратами невозможно. Во II триместре допустимо применение метронидазола и его производных в формах для местного использования, например в форме вагинальных свечей. Применение таблетированных форм метронидазола и его производных возможно лишь в III триместре.
Хламидийная инфекция
Несмотря на довольно низкую ожидаемую вероятность инфицирования плода при хламидийной инфекции (6–8%) при частоте передачи её в 50–70%, необходима своевременная и высокоэффективная антибактериальная терапия.
Среди антибиотиков, разрешённых для лечения хламидийной инфекции при беременности (эритромицин, джозамицин, ровамицин), наиболее привлекателен вильпрафен (джозамицин), широкий спектр антимикробной активности и низкая резистентность возбудителей к которому позволяют излечивать смешанные урогенитальные инфекции (хламидии +микоплазмы) уже в I триместре. Многолетний опыт применения показал его высокую эффективность и безвредность для плода в дозе 500 мг 3–4 раза в день в течение 10 дней.
Мико- и уреаплазменная инфекции
На вопрос, лечить или нет мико- и уреа-плазменную инфекцию, ответим цитатой проф. М.А. Башмаковой (2004): «Полжизни я посвятила мико- и уреаплазмам, а остаток отдаю тому, чтобы женщин не лечили без показаний».
С учётом того, что урогенитальные микоплазмы являются бактериальной вагиноз-ассоциированной микрофлорой, при колонизации нижних половых путей беременных М. hominis и/или U. Urealyticum рекомендуется рутинный комплекс диагностических и при необходимости лечебных мероприятий по восстановлению нормального микроценоза влагалища.
При наличии показаний, по мнению ряда исследователей, в качестве препаратов первого ряда при микоплазменной инфекции должны использоваться макролиды. В группе макролидов самые низкие минимальные подавляющие концентрации для микоплазм имеет джозамицин.
Благодаря высокой активности и хорошей переносимости он является одним из самых широко применяемых антибиотиков для лечения урогенитальных инфекций.
Джозамицин обладает широким спектром антибактериального действия, включающим как все клинически значимые микоплазмы (M. hominis, M. genitalium, U.
urealyticum), так и хламидии.
Бактериальный вагиноз в I триместре
Несмотря на многочисленные исследования по коррекции микробиоценоза влагалища, терапия бактериального вагиноза во время беременности остаётся сложной проблемой из-за возможного неблагоприятного воздействия дезинфектантов на плод.
В I триместре использование дезинфектантов не рекомендуется, более того — опасно, так как они относятся к категориям С и D риска для плода. Хотя доказана эффективность лечения бактериального вагиноза назначением клиндамицина фосфата и метронидазола, однако назначение таковых безопасно лишь во II–III триместре беременности (Азарова О.Ю. и соавт., 2002).
Весомую конкуренцию пероральным препаратам с антианаэробной активностью может составить повидон-йод, отличающийся от всех остальных средств эффектом сохранения кислой среды влагалищного содержимого. Препятствуя вегетированию патогенных и условно-патогенных микроорганизмов, препарат создаёт благоприятные условия для размножения лактобактерий. Согласно современным тенденциям, возможно использование крема или свечей далацина.
Совсем недавно появился новый эффективный метод лечения бактериального вагиноза — особая интравагинальная форма аскорбиновой кислоты («Вагинорм-С®»). Особенностью препарата является то, что за счёт снижения рН влагалища до нормальных значений подавляется рост анаэробной микрофлоры и одновременно стимулируется рост собственных лактобактерий рода Lactobacillus.
Восстановление биоценоза – обязательный этап
Необходимо отметить: после антибактериальной терапии, которая ликвидирует условно-патогенные микроорганизмы, условия для достаточно быстрого восстановления нормальной микрофлоры влагалища сами по себе не создаются.
Беременность, протекающая в условиях аномального биоценоза, безоговорочно сопровождается высоким риском акушерских и перинатальных осложнений. Именно поэтому будет логично завершать использование любой обоснованной «санации» влагалища восстановлением пула лактобактерий.
Принципиальным отличием современных эубиотиков является основа — не сухое молоко, как раньше, а фруктоолигосахариды (яблочный пектин, морковный порошок). Созданные на сухом молоке эубиотики при наличии нитей мицелия «створаживались» и выпадали из влагалища в виде творожистых выделений: для здоровья неопасно, эстетически — неприемлемо.
Теперь ситуация в корне изменилась: восстановление эубиоза дотацией лактобактерий можно начинать в момент завершения использования дезинфектантов, антимикотиков etc. Поэтому при беременности вполне достаточно провести местное лечение с обязательным восстановлением эубиоза лактобактериями на безмолочной, фруктоолигосахаридной основе («Флоралдофилус» — симбионт последнего, IV поколения).
В силу низких адгезивных свойств лактобактерий достижение выраженной ацидофильной ориентации вагинальных микроорганизмов возможно лишь при соблюдении следующих условий: достаточного количества бифидо- и лактобактерий в кишечнике и отсутствия запоров.
В 65–80% следствием хронических запоров являлось резкое снижение численности лакто- и бифидофлоры или её конкурентное замещение штаммами E. coli со сниженными ферментативными или патогенными свойствами, активация условно-патогенной микрофлоры (кишечная палочка, золотистый и эпидермальный стафилококк и др.) [Гвасалия А.Г., 2004]. На фоне устранения констипации происходит прирост содержания лактобактерий в 3 раза.
В заключение нужно отметить: профилактика осложнений беременности и родов требует совершенно определённой тактики — грамотного инфекционного скрининга и своевременного, адекватного выявленному возбудителю лечения. Главное — достичь нормального биоценоза с содержанием лактобактерий не менее 107 КОЕ/мл на протяжении беременности и в конце родов, потому что ребёнок должен контаминировать не кишечную палочку и энтерококк, а здоровую лактофлору здоровой матери.
Текст: проф. В.Е. Радзинский, к.м.н. М.Л. Полина