Холецистография – суть и цели исследования
Диагностические методы, использующие рентгеновские лучи для получения изображения внутренних органов человека, начали применяться в медицине ещё в первой половине 20 столетия. Благодаря открытию Х-лучей в 1895 году, наука того времени получила мощный инструмент для изучения костной, мышечной, соединительной и иных видов тканей, а также органов и сосудистой системы без применения хирургического вмешательства.
Содержание:
- Холецистография – суть и цели исследования
- Жёлчный пузырь и жёлчные протоки: анатомия и функционирование
- Разновидности холецистографии
- Показания к процедуре, возможные противопоказания
- Как следует готовиться к обследованию
- Порядок проведения диагностики жёлчного пузыря
- Проведение холеграфии детям
- Особенности интерпретации результатов исследования
Рентгенография жёлчного пузыря с использованием контраста впервые экспериментально было проведена в 1923-1924 годах. Тогда учёные внутривенно вводили натриевую соль тетрайодфенолфталеина собакам, после чего осуществляли фиксацию изображения органа на снимках. Многие теоретики и практики медицины осуществляли разработку этого метода в дальнейшем, приложив все усилия для того, чтобы эксперимент, проведённый на животных, стал полноценным способом обследования жёлчных путей и пузыря человека. Я.Г. Диллон, А.А. Лемберг, Н.Е. Штерн, Н.Ф. Мордвинкин и другие учёные работали в направлении изучения возможностей контрастной рентгенографии жёлчного пузыря и жёлчных протоков.
С изобретением в 1946 году специального контрастирующего вещества – дийодированного производного а-фенилпропионовой кислоты – процедура стала немного более безопасной для здоровья человека. Билитраст, а также синтезированные позже везипак, триодан, цистобил, телепак позволяют увеличить процент положительных холецистографий: примерно в 50-70% исследований удаётся достичь качественного изображения внутрипечёночных жёлчных протоков.
С какими целями лечащий врач может назначить проведение процедуры? Обследование проводится для:
- установления размеров и контуров жёлчного пузыря;
- оценки сократимости стенок органа;
- отображения размеров и контуров жёлчных протоков;
- выявления камней в пузыре и протоках;
- подтверждения наличия воспалительных или опухолевых процессов.
ХОЛЕЦИСТОГРАФИЯ
ХОЛЕЦИСТОГРАФИЯ
(греческий сhole желчь + kystis пузырь + grapho писать, изображать; синоним:
контрастная холецистография, концентрационная холецистография
) — рентгенологический метод исследования желчного пузыря, заключающийся в его рентгенографии через определенное время после введения в организм специальных рентгеноконтрастных веществ, которые улавливаются из крови печенью, выделяются с желчью и накапливаются в желчном пузыре.
Холецистография разработана в 1923 — 1924 годы американскими хирургами Э. Грэмом и Коулом (W. H. Cole). Этот метод быстро вошел в клиническую практику ввиду относительной простоты и безопасности. Холецистография позволяет исследовать морфологию и функцию желчного пузыря (cм.), обнаружить в нем патологические изменения (аномалии развития, конкременты, воспалительный процесс, опухоль).
Холецистография показана во всех случаях, когда необходимо выяснить состояние желчного пузыря больного; ее можно проводить людям любого возраста. Противопоказаниями являются идиосинкразия больного к йоду и острые дистрофические поражения печени. Относительным противопоказанием считают коронарную недостаточность и выраженное нарушение функции печени и почек. В последние годы холецистографию стали применять реже в связи с развитием ультразвуковой диагностики (см.) заболеваний желчных путей, а также радиоизотопной холецистографии (см. Желчный пузырь, методы исследования; Холеграфия радиоизотопная).
Рентгеноконтрастное вещество можно вводить внутривенно, через рот, через зонд в двенадцатиперстную кишку или с помощью клизмы в прямую кишку. В настоящее время контрастное вещество, как правило, вводят перорально. В качестве рентгеноконтрастных веществ используют йодистые органические соединения. Современные рентгеноконтрастные вещества, вводимые перорально, которые применяют для X., — иопаноевая кислота (холевид, йопагност, телепак), билимин и др.— представляют собой производные трийодированного бензола.
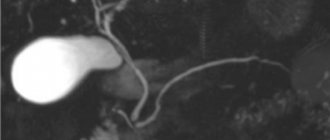
Рис. 1. Холецестограмма в норме (прямая проекция) при вертикальном положении больного: тень желчного пузыря интенсивна и однородна.
Специальной подготовки к холецистографии не требуется. Накануне дня исследования вечером после ужина больной принимает рентгеноконтрастный препарат в дозе 1 г на 20 кг массы тела, запивая его водой, фруктовым соком или сладким чаем. Рентгеноконтрастное вещество в желудке не всасывается, оно резорбируется в тонкой кишке и, поступая в кровь, связывается с альбуминами сыворотки. Гепатоциты выводят рентгеноконтрастное вещество из крови в желчь в форме водорастворимого метаболита. Концентрация препарата в желчи невысока, в связи с чем тень желчных протоков при рентгенографии обычно плохо различима. В желчном пузыре из-за происходящего в нем сгущения желчи препарат концентрируется, и тень пузыря появляется на рентгенограммах через 3—4 часа. Изображение постепенно усиливается, достигая максимума через 15—17 часов (рис. 1). У детей оптимальное контрастирование наступает быстрее.
Холецистографию производят натощак, в 9—10 часов утра на следующий день после приема препарата. Сначала обычно делают обзорную рентгенограмму в вертикальном положении больного, иногда — сразу прицельные снимки желчного пузыря под контролем рентгеноскопии (отдельные снимки выполняют при компрессии области желчного пузыря тубусом рентгеновского аппарата). При выраженном метеоризме прибегают к очистительным клизмам, однако если и после этого скопление газа в толстой кишке препятствует получению отчетливого изображения желчного пузыря, то выполняют томографию или зонографию (см. Томография). По снимкам оценивают положение, форму, величину, контуры, интенсивность и структуру тени желчного пузыря. Для установления взаимоотношений желчного пузыря с желудком и двенадцатиперстной кишкой больному дают выпить водную взвесь сульфата бария.
Рис. 2. Холецистограмма (прямая проекция) при одиночном холестероловом полипе желчного пузыря: стрелкой указан дефект наполнения, обусловленный полипом. Рис. 3. Холецистограмма при желчнокаменной болезни (прямая проекция): видны множественные просветления в желчном пузыре, обусловленные желчными камнями. Рис. 4. Серия холецистограмм до и после приема желчегонного завтрака в норме: 1 — до приема желчегонного завтрака; 2—7 — в период сокращения желчного пузыря; 8 — в период начавшегося расслабления желчного пузыря.
При холецистографии могут быть обнаружены дефекты (просветления) в тени желчного пузыря (рис. 2, 3), которые обусловлены камнем (см. Желчнокаменная болезнь), холестероловым полипом (см. Холестероз) либо опухолью. Если дефектов заполнения пузыря нет, больному с целью усиления моторики желчного пузыря дают выпить 20 г сорбита, растворенного в стакане воды. С той же целью исследуемому можно дать 60 мл сырого яичного желтка или другой так наз. желчегонный завтрак, напр, завтрак Бойдена, состоящий из смеси двух яичных желтков и одного стакана сливок. На снимках через 15-20 минут нередко удается получить тень общего желчного протока (см. Желчные протоки), заполняющегося контрастированной желчью из пузыря. Кроме того, на рентгенограммах сократившегося желчного пузыря (спустя 20—45 минут после приема желчегонного завтрака) могут быть обнаружены мелкие камни или полипы, которые не были заметны на снимках до сокращения пузыря. Серия снимков позволяет оценивать двигательную функцию желчного пузыря (рис. 4). Более сильное и быстрое сокращение пузыря происходит после внутривенного или внутримышечного введения холецистокинина (см.), но к этому прибегают редко ввиду возможности появления болей в животе и рвоты.
Рентгеноконтрастное вещество, частично перешедшее в кишечник с желчью, выводится с испражнениями, часть же его повторно всасывается и циркулирует в печеночно-кишечном круге. Поэтому выявление тени желчного пузыря на рентгенограммах возможно и на следующий день. На этом основана и методика так наз. насыщения при холецистографии. Если тень желчного пузыря на рентгенограммах в первый день исследования отсутствует, то больному в течение дня дают дополнительно одну или две полные дозы рентгеноконтрастного вещества и повторяют исследование утром на следующий день.
Побочные явления
при холецистографии выражены слабо. Бывают головокружение, тошнота, жидкий стул, чувство давления в эпигастральной области. При симптомах йодизма назначают антигистаминные препараты, остальные побочные явления исчезают без лечения.
Библиогр.:
Линденбратен Л. Д. Рентгенология печени и желчных путей, М., 1980; Линденбратен Л. Д. и Наумов Л.Б. Методы рентгенологического исследования органов и систем человека, Ташкент, 1976; Петрова И. С. и Поляк Е. 3. Рентгено-радиологические исследования желчевыводящих протоков, Киев, 1972; GrahamE. А. а. Соle W. Н. Roentgenologic examination of the gall-bladder, J. Amer. med. Ass., v.82, p. 613, 1924; Hatfield P. a. Wise R. E. Radiology of the gall bladder and bile ducts, Baltimore, 1976; Rontgen-diagnostik der Leber und der Gallenwege, hrsg. v. F. Heuck, B. u. a., 1976.
Л. Д. Линденбратен.
Жёлчный пузырь и жёлчные протоки: анатомия и функционирование
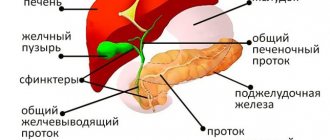
Жёлчный пузырь имеет вид небольшого грушевидного мешочка. Главная его функция – накопление жёлчи, вырабатываемой печенью. Анатомически в пузыре различают дно, стенки или среднюю часть, и шейку, при этом дно имеет более широкий диаметр, а далее стенки и шейка постепенно сужаются. Длина пузыря составляет от 8 до 12 сантиметров, ширина – 3-5 сантиметров. Стенки жёлчного пузыря имеют небольшую толщину. Окрас органа – тёмно-зелёный или серо-зелёный.
От проксимальной узкой части – шейки пузыря – отходит пузырный проток, имеющий вид полой трубки. Соединяясь с печёночным протоком, он образует общий жёлчный проток.
Пузырь расположен на висцеральной стороне печени, он залегает в специальной ямке в органе. Это углубление разделяет передний отдел правой доли печени и квадратную долю. Дно пузыря направлено к нижнему краю печени, шейка смотрит в сторону печёночных ворот. В месте, где тело пузыря переходит в шейку, обычно находится функциональный изгиб, и шейка лежит под некоторым углом к телу.
Пузырь прилегает к ямке своей передней поверхностью, где соединяется с фиброзной оболочкой печени. Его поверхность, направленная к брюшной полости, покрыта висцеральной брюшиной, которая переходит с печени на пузырь.
Стенки жёлчного пузыря состоят из трёх слоёв:
- наружного серозного;
- мышечного;
- внутреннего слизистого.

В области брюшины стенка покрыта рыхлым тонким соединительнотканным слоем – подсерозной основой.
Существует три жёлчных внутрипечёночных протока:
- общий печёночный;
- пузырный;
- общий жёлчный.
Первый из них расположен в воротах печени, состоит из двух других печёночных протоков – левого и правого. Спускаясь в печёночно-дуоденальной связке, общий печёночный проток переходит в пузырный проток, исходящий из шейки пузыря, образуя общий жёлчный проток.
Основная функция жёлчного пузыря – работа в неразрывной связке с печенью. В мешочке накапливается выработанная печенью жёлчь до того момента, пока в организм не поступит еда. Для переработки жирной и калорийной пищи пузырь выбрасывает в двенадцатиперстную кишку запас жёлчи, которая, вместе с поджелудочными и кишечными ферментами, подвергает пищевой комок обработке. В свою очередь, жёлчные протоки осуществляют перенос накопленной жёлчи в кишечник.
Разновидности холецистографии
Основной признак, по которому медики дифференцируют процедуру холецистографии или холеграфии – способ попадания контрастного вещества в организм пациента. По тому, каким путём вводят контрастное вещество, выделяют такие виды рентгенологического обследования жёлчного пузыря:
- внутривенную холецистографию, когда контраст вводится в тело обследуемого через сосудистую систему струйно с помощью шприца;
- пероральную процедуру: в таком случае обследуемый выпивает специальный раствор, содержащий контрастирующее вещество;
- инфузионную холеграфию: контрастирующее вещество очень медленно вводится внутривенно капельно специальным катетером;
- чрескожную: метод используется, если у пациента есть диагностированные нарушения функции печени, контраст при этом вводится пункционно в жёлчный пузырь и протоки.
Следует отметить, что последний способ диагностики практически не используется сейчас, так как нередко вызывает осложнения – сепсис, аллергию, в некоторых случаях – летальный исход.
Показания к процедуре, возможные противопоказания

Учитывая, что холецистография непосредственно использует свойства рентгеновских лучей, а для получения снимка пациенту обязательно вводится контрастный препарат, для назначения такого обследования должны быть объективные причины – показания к проведению.
Среди таких показаний необходимость подтвердить один из возможных диагнозов:
- подозрение наличия холецистита;
- опухолевые заболевания органа;
- дискинезию;
- камни в протоках или жёлчном пузыре.
Также диагностика может назначаться при наличии у пациента некоторых симптомов:
- болей в правом подреберье;
- горечи во рту;
- отрыжки, тошноты, рвоты, тяжести в правом боку, особенно после приёма пищи;
- обесцвечивания кала, сопровождающегося значительным потемнением мочи.
Что касается запретов к назначению диагностики, они связаны, в основном, с введением контраста в организм. Противопоказания могут быть абсолютными или относительными. Первые делают осуществление процедуры полностью невозможным из-за уровня риска для обследуемого. Холецистография противопоказана больным с:
- печёночной недостаточностью;
- аллергией на контрастные препараты;
- сердечно-сосудистой недостаточностью;
- острыми воспалительными заболеваниями печени.
Относительные противопоказания требуют решения лечащего врача в каждом конкретном случае – если необходимость диагностики и польза от неё превышают потенциальный вред, доктор может назначать холецистографию под свою ответственность.
Относительными противопоказаниями являются:
- острый холангит;
- цирроз печени
- беременность, кормление грудью;
- желтуха.
Желчнокаменная болезнь: алгоритм диагностики и лечения
Ж
елчнокаменная болезнь (ЖКБ) относится к числу широко распространенных заболеваний. В хирургических стационарах среди больных с хроническими заболеваниями органов брюшной полости больные ЖКБ занимают первое место. В послевоенный период в экономически развитых странах Европы и Северной Америки число больных ЖКБ значительно возросло. Об этом свидетельствует количество выполняемых хирургами операций – к примеру, только в США ежегодно проводятся более 500 000 холецистэктомий. В нашей стране также отмечается высокая заболеваемость ЖКБ, и в каждое последующее десятилетие число больных удваивается. Эту болезнь справедливо считают “болезнью века” и “болезнью благополучия”, имея в виду непосредственную связь ее развития с характером питания.
В последние три десятилетия достигнуты значительные успехи в решении вопросов диагностики и лечения ЖКБ, во многом обусловленные прогрессом в области разработки медицинской техники и фундаментальных наук. Благодаря этим достижениям во врачебной практике появились эффективные методы диагностики:
ультразвуковое исследование (УЗИ), компьютерная томография, магнитно-ядерная томография, прямые методы контрастирования билиарного тракта. Наряду с этим не утратили своего значения такие методы исследования, как
пероральная холецистография и внутривенная холеграфия.
К традиционному лечению с помощью открытой холецистэктомии добавились методы лапароскопического вмешательства и малотравматические операции из минидоступа. Более того, в распоряжении врачей появились
неоперативные методы лечения:
медикаментозное растворение и экстракорпоральное дробление камней. Широкий спектр диагностических и лечебных методов привел к пересмотру стратегии и тактики при ЖКБ. Естественно, возникла необходимость в оптимизации выбора диагностических исследований и метода лечения индивидуально для каждого пацмента.
Необходимость в избавлении больного от ЖКБ продиктована не только возникающими приступами желчных колик, но и опасностью возникновения тяжелых осложнений (острого холецистита, механической желтухи, деструктивного панкреатита и др.), которые могут потребовать срочного оперативного вмешательства, а при длительном течении основного заболевания – развитием рака желчного пузыря. Поэтому лечению должны подлежать как больные с симптоматической ЖКБ, так и с латентно протекающей ее формой, при которой всегда существует угроза внезапного тяжелого осложнения патологического процесса. Рекомендация больному определенного метода лечения должна быть основана на оценке его физического состояния, характера заболевания, сопутствующих изменений в желчных протоках (камни, стриктура). Необходимую для этого информацию можно получить с помощью ряда инструментальных и лабораторных исследований.
Диагностика
Ультразвуковое исследование
Основной метод диагностики ЖКБ. Его неинвазивность, безопасность и простота выполнения позволяют обследовать большой контингент населения и прибегать к повторному исследованию в ближайшие 2–3 дня в случае неудачи или неинформативности первичного исследования. УЗИ позволяет определить:
наличие камней в желчном пузыре, их количество и размеры, суммарный объем и, что немаловажно, качественный состав конкрементов; расположение, размеры и форму желчного пузыря, толщину его стенки и наличие в нем сужений, степень воспалительно-инфильтративных изменений; диаметр гепатикохоледоха и наличие камней в нем. Вариант функционального УЗИ с использованием желчегонного завтрака позволяет оценить сократительную и эвакуаторную функции желчного пузыря.
.
Пероральная холецистография
Метод рентгеноконтрастного исследования желчного пузыря, основанный на пероральном приеме йодосодержащих препаратов. Его применение целесообразно в тех случаях, когда необходимо располагать точными данными о функциональном состоянии желчного пузыря, рентгенопрозрачности конкрементов и степени их кальцификации. Эти сведения чрезвычайно важны для отбора больных на литолитическую терапию и экстракорпоральную литотрипсию (ЭКЛТ). Одним из недостатков метода является невозможность контрастирования желчных протоков, о состоянии которых необходимо знать во всех без исключения случаях, когда больному предписывают лечение.
Внутривенная холеграфия
Основанный на внутривенном введении контрастного раствора метод дает возможность получить четкое изображение не только желчного пузыря, но и внепеченочных желчных протоков. Это обстоятельство чрезвычайно важно для выявления камней в желчных протоках, определения степени их дилатации или сужения. Обнаружение на холангиограммах даже умеренного расширения желчных протоков является косвенным признаком нарушения желчеоттока в кишечник, и в этом случае необходимы дополнительные исследования для выявления причины желчной гипертензии. Проведение внутривенной холеграфии абсолютно показано в тех случаях, когда на основании анамнестических и клинических признаков возникает подозрение на сопутствующее поражение желчных протоков – наличие в них камней и стриктуры. Для снятия этих подозрений можно прибегнуть к применению эндоскопической ретроградной холангиопанкреатографии
(ЭРХПГ). Но по сравнению с этим диагностическим методом внутривенная холеграфия является щадящим и менее опасным методом, которому не свойственны опасные для жизни осложнения.
Гепатобилиосцинтиграфия
| Оперативное удаление желчного пузыря рассматривают как радикальный метод лечения ЖКБ. |
Относится к числу радиоизотопных методов исследования с регистрацией с помощью гамма-камеры движения радиофармпрепарата через клетки печени и желчные пути. Нормальные показатели скорости выделения радиофармпрепарата из клеток печени, его движения и эвакуации из желчных протоков достоверно свидетельствуют об отсутствии нарушения желчеоттока в кишечник. При замедлении скорости движения радиофармпрепарата по внепеченочным желчным протокам и задержке его выделения в просвет двенадцатиперстной кишки следует заподозрить наличие в них конкрементов или стриктуры. Для разрешения этих сомнений требуется проведение рентгеноконтрастных исследований (внутривенной холеграфии, ЭРХПГ или интраоперационной холеграфии). Метод гепатобилиосцинтиграфии (ГБСГ) позволяет оценить функциональное состояние желчного пузыря и печеночных клеток
, что особенно важно при подозрении на наличие у больного хронического гепатита. Малая инвазивность, высокая технологичность и информативность являются основанием для применения ГБСГ во всех случаях неосложненной ЖКБ, когда положительно решен вопрос о назначении больному неоперативного или оперативного метода лечения. Нормальные показатели функционального состояния желчных протоков по данным ГБСГ позволяют отобрать больных на изолированную холецистэктомию и не прибегать при этом к рентгеноконтрастным исследованиям как до операций, так и во время нее.
Биохимическое исследование крови
Необходимо для оценки функционального состояния печени и характеристики липидного обмена. В биохимическом анализе определяют уровень билирубина
(прямой и непрямой фракции),
аланин- и аспартатаминотрансферазы, щелочной фосфатазы, холестерина и триглицеридов
. Нормальные показатели уровня билирубина и активности основных ферментов печени указывают на отсутствие активного воспалительного процесса в гепатоцитах. Обнаруженный высокий уровень плазменных холестерина и триглицеридов свидетельствует о связи заболевания с нарушением липидного обмена. Этому факту следует придать особое значение, так как больным с гиперхолестеринемией помимо предложенного базисного лечения необходимо проводить гипохолестеринемическую терапию, направленную на профилактику рецидива камнеобразования.
Лечение
Как показывает многолетний опыт, консервативная терапия, которую практикуют многие поликлинические врачи, неэффективна при ЖКБ. Рекомендуемые ими лечебные мероприятия не только не предупреждают появления желчных колик, но и могут их спровоцировать вследствие миграции конкрементов и закупорки биллиарного тракта. Более того, длительное пребывание камней в желчном пузыре грозит осложнениями и развитием воспалительного процесса, что затрудняет в дальнейшем хирургическое вмешательство и ухудшает его результаты. Поэтому при ЖКБ не следует годами проводить консервативное лечение и ожидать от него эффекта. При установленном диагнозе необходимо своевременное применение эффективных методов лечения, которые избавят больного от камней или желчного пузыря. Наблюдения показывают, что в ранние сроки заболевания существующие методы лечения, будь то литотрипсия или операция, дают лучшие результаты, лечение протекает более успешно с низким риском осложений и летального исхода. Применение того или иного метода лечения ЖКБ не должно ограничиваться возрастом больного.
При выборе способа лечения определяющим фактором должен быть не возраст больного, а его общее физическое состояние и степень операционного риска.
Литолитическая терапия
Идея растворения камней желчного пузыря медикаментозными средствами захватывает исследователей всего мира. Она привлекательна тем, что при успешном применении препаратов отпадает необходимость в операции, при которой всегда существует риск неблагоприятного исхода. В медицинской практике метод медикаментозного растворения желчных камней появился в начале 70-х годов, когда была получена хенодеоксихоловая кислота
, а в последующем –
урсодеооксихоловая кислота
(УДХК). Лекарственные препараты этого ряда снижают содержание холестерина в желчи за счет торможения его синтеза в печени и увеличивают пул желчных кислот в желчи. В результате желчь теряет литогенность и наступает растворение камней.
Терапевтический эффект при энтеральном применении литолитических препаратов достигается у больных с желчными камнями, состоящими преимущественно из холестерина. А, как известно, большинство конкрементов являются смешанными, содержащими также билирубин, белки и различные соли. В этой связи использование литолизиса возможно лишь у 20% больных, страдающих ЖКБ. Применение метода показано тяжелым больным с высоким операционно-анестезиологическим риском и больным, отказывающимся от операции или экстракорпоральной литотрипсии (ЭКЛТ). Метод литолизиса имеет много противопоказаний к назначению, при недоучете которых терапевтический эффект не достигается и возможны осложнения.
Лечебный эффект при приеме литолитических препаратов можно ожидать через 1,5–2 года.
Суточная доза препарата УДХК составляет 10–15 мг/кг. Лучшие результаты наблюдают при ограничении употребления жирной пищи, насыщенной холестерином. Основным недостатком метода литолизиса является невысокая эффективность. Даже при строгом отборе больных растворить камни или уменьшить их размеры удается не более чем у 60% из них, причем этот эффект достигается при мелких чисто холестериновых камнях. После прекращения приема медикаментозных препаратов отмечен высокий процент рецидива заболевания. Недостаточно высокая эффективность ограничивает применение литолитической терапии, как самостоятельного метода лечения ЖКБ. Более широко его применяют в комплексе с другими методами и, в частности, с дистанционным дроблением камней.
Экстракорпоральная литотрипсия
Метод неинвазивного дробления конкрементов желчного пузыря вошел в медицинскую практику в 1985 г. Появление этого метода породило у врачей надежду на возможность его широкого использования, что позволило бы многим больным избежать операции. Однако первые наблюдения показали, что далеко не каждому больному можно рекомендовать эту лечебную процедуру и не во всех случаях достигается положительный результат. Для получения лечебного эффекта необходим строгий отбор больных. Опыт показывает, что эффективность экстракорпоральной литотрипсии (ЭКЛТ) зависит от свойств конкрементов
, определяющих успех их фрагментации и элиминации, а также
от функционального состояния желчного пузыря
, определяющего частоту развития осложнений и
побочных эффектов периода элиминации и ранних рецидивов камнеобразования
.
Критериями отбора больных с холецистолитиазом (с симптоматической и бессимптомной формами заболевания) для проведения ЭКЛТ являются: единичные и немногочисленные (2–4) конкременты, занимающие менее 1/2 объема желчного пузыря; сохраненная сократительно-эвакуаторная функция желчного пузыря. Успех лечения во многом зависит от наличия в конкрементах солей кальция и степени их кальцификации. Хорошие результаты лечения достигаются у больных с эхопроницаемыми и эхонеплотными (не содержащими солей кальция) рентгенопрозрачными конкрементами, по мере увеличения их эхонепроницаемости и эхоплотности с признаками рентгеноконтрастности эффективность дробления падает.
Противопоказанием к применению ЭКЛТ являются: множественный холецистолитиаз, занимающий более 1/2 объема желчного пузыря; кальцинированные камни; снижение сократительно-эвакуаторной функции желчного пузыря и “отключенный” желчный пузырь; конкременты желчных протоков и билиарная обструкция; невозможность проведения энтерального литолизиса после дробления конкрементов (гастродуоденальная язва, аллергия); беременность.
О результатх литотрипсии судят через 3–18 мес
, когда происходит освобождение желчного пузыря от фрагментов камней. Для ускорения процесса элиминации и уменьшения размеров фрагментов больным назначают оральную литолитическую терапию. В ближайшем и отдаленном периодах процесс элиминации фрагментов может давать осложнения в виде приступов желчных колик, острого холецистита, обтурационной желтухи и острого панкреатита. Следует отметить, что эти осложнения возникают редко. При строгом отборе больных хорошие результаты лечения (полное освобождение желчного пузыря от конкрементов) наблюдается у 65–70% больных. Неудовлетворительные результаты ЭКЛТ, когда фрагменты не выходят из желчного пузыря или, напротив, увеличиваются в размерах, связаны либо с неправильной оценкой функции желчного пузыря, либо с качественным составом камней. После успешно проведенной литотрипсии возможен рецидив камнеобразования, отмечаемый у 20–23% больных, перенесших эту процедуру (большинство из них имеют нарушения липидного обмена). Мерой профилактики рецидива заболевания у этой категории больных является проведение корригирующей холестеринснижающей терапии.
Неоперативным методам лечения присущ один существенный недостаток – непатогенетичность терапии. Ожидать хороших результатов лечения при их применении в отдаленном периоде не приходится, так как при невозможности воздействовать на все звенья патогенеза заболевания еще остается желчный пузырь – орган, формирующий конкременты. Вот почему оперативное удаление желчного пузыря рассматривают, как радикальный метод лечения ЖКБ
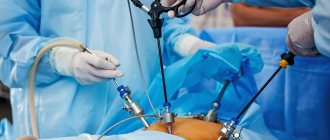
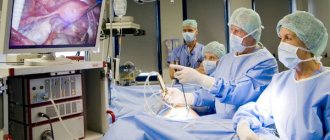
, избавляющий больного от желчных колик и опасных осложнений. В настоящее время в медицинских учреждениях применяют три способа удаления желчного пузыря: лапароскопический, хирургический из минимального операционного доступа и из стандартной лапаротомии.
Лапароскопическая холецистэктомия
Появление в медицинской практике метода лапароскопической холецистэктомии (ЛХЭ) явилось новой вехой в развитии хирургии ЖКБ. За чуть более чем 10-летний период существования она завоевала широкое признание и получила дальнейшее совершенствование. Эндоскопическим методом стали производить до 70–80% холецистэктомий.
К показаниям для проведения ЛХЭ
относят симптоматическую неосложненную ЖКБ, бессимптомно протекающую форму заболевания и холестероз желчного пузыря. Совершенствование технологии эндоскопической операции позволило расширить показания к вмешательству при сочетанных поражениях желчных протоков. Среди противопоказаний к этой операции выделяют плотный воспалительный инфильтрат в области шейки желчного пузыря и гепатодуоденальной связки, беременность, перенесенные лапаротомии, ожирение, цирроз печени, внутрипеченочное расположение желчного пузыря, механическую желтуху и острый панкреатит. Некоторые авторы считают эти противопоказания, за исключением первых двух, относительными и при этом подчеркивают, что успех операции во многом определяется уровнем подготовки хирурга и технической оснащенностью операционной. Однако недооценивать эти противопоказания нельзя, так как при указанных ситуациях существует риск развития интраоперационных осложнений и к тому же возникает необходимость в конверсии (переходе к лапаротомии), что удлиняет время операции в 2–3 раза.
Операцию ЛХЭ проводят обычно под общим обезболиванием, добиваясь при этом глубокой релаксации брюшной стенки. Основными этапами эндоскопической операции являются:
создание пневмоперитонеума, введение троакаров и инструментов, ревизия брюшной полости, выделение желчного пузыря из сращений, пузырного протока и пузырной артерии с последующим их клипированием и пересечением; выделение желчного пузыря из ложа печени и извлечение его из брюшной полости (иногда с использованием контейнера) и установка контрольного дренажа в подпеченочном пространстве. Для введения троакаров в брюшную полость производят дугообразный разрез длиной 1,5–2 см над или под пупком и три разреза длиной 5–6 мм в правом подреберье.
Небольшая травматичность при операции ЛХЭ, щадящая инструментальная техника обеспечивают легкое течение послеоперационного периода, кратковременное нахождение больного в стационаре (3–5 дней) и сокращение сроков восстановления трудоспособности (2,5–3 нед). Этими факторами определяется низкий процент послеоперационных осложнений со стороны операционной раны, брюшной полости и сердечно-легочной системы. Перечисленные достоинства ЛХЭ делают ее социально значимой и перспективной в лечении ЖКБ.
Наряду с неоспоримыми преимуществами операция ЛХЭ таит в себе опасность развития серьезных осложнений: кровотечение в брюшную полость, пересечение холедоха, травма внутренних органов, желчеистечение в брюшную полость, гнойный процессы в зонах вмешательства. Причинами их возникновения чаще всего являются спаечный и воспалительный процесс в гепатодуоденальной зоне; нарушение техники операции и отказ от своевременного перехода к широкой лапаротомии. При операции ЛХЭ послеоперационная летальность невысокая, она колеблется от 0,5 до 1,5%.
Холецистэктомия из мини-лапаротомного доступа
В нашей стране приоритет в разработке технологии холецистэктомии из малого оперативного доступа принадлежит И.Д. Прудкову и его последователям.
Этот способ операции холецистэктомии состоит из открытого малого оперативного доступа с элементами эндохирургии.
Операцию осуществляют с помощью комплекта инструментов, включающего в себя кольцевой ранорасширитель, шарнирные ретракторы-зеркала (изменяющие свою геометрию), осветительный прибор и электрокоагуляторы.
Для выполнения операции из мини-доступа производят вертикальный трансректальный разрез длиной 4–5 см в правом подреберье. Ретракторы-зеркала создают значительное по объему операционное пространство, позволяющее оперировать на глубине 5–20 см, визуально контролировать ход операции и свободно манипулировать инструментами. Изменяя положение ретракторов-зеркал и увеличивая тем самым операционное пространство в зоне “интереса”, можно производить не только изолированную холецистэктомию, но и расширить вмешательство: выполнить холедохолитотомию, холедохоскопию, сформировать супрадуоденальный холедоходуоденоанастомоз.
Применение мини-лапаротомного доступа при холецистэктомии целесообразно в тех случаях, когда имеются противопоказания к лапароскопическому вмешательству. Технология этой операции позволяет произвести удаление желчного пузыря при наличии воспалительной инфильтрации и спаечного процесса в зоне гепатодуоденальной связки; при ранее перенесенных лапаротомиях, когда можно ожидать спаяния органов брюшной полости с брюшной стенкой; при ожирении и внутрипеченочном расположении желчного пузыря. Мини-доступ предпочтителен у больных с сопутствующими заболеваниями сердечной и легочной систем, у которых нежелательно создавать напряженный пневмоперитонеум.
Операция холецистэктомия из мини-доступа не является альтернативой лапароскопического способа. По многим параметрам медицинского характера эти способы операции существенно не отличаются друг от друга. Однако операции из мини-доступа присуща несколько повышенная травматичность из-за длины разреза брюшной стенки, введения инструментов и тампонов в брюшную полость. Несомненными преимуществами операции холецистэктомии из минимального оперативного доступа являются: сходность техники и приемов оперирования с открытой лапаротомией и визуальный контроль за этапами операции, что снижает риск ятрогенных осложнений, позволяет хирургу легко преодолеть психологический барьер и быстро перейти к открытой лапаротомии, если возникают технические трудности. Кроме того, себестоимость операции из мини-доступа в 2,5–3 раза меньше лапароскопической операции. Перечисленные достоинства операции холецистэктомии из мини-доступа с использованием отечественного инструментария делают ее привлекательной для хирургов. В настоящее время во многих лечебных учреждениях нашей страны эта операция вытеснила открытый метод оперативного вмешательства.
Холецистэктомия из открытого лапаротомного доступа
Удаление желчного пузыря из стандартного широкого лапаротомного доступа относится к категории травматичных вмешательств с повышенным риском развития осложнений. Несмотря на этот недостаток широкой лапаротомии, необходимость в ее применении остается при осложненном течении ЖКБ, когда требуется вмешательство на внепеченочных желчных протоках, а также в хирургии острого холецистита. Вынужденный переход на широкую лапаротомию возникает при операциях лапароскопических и из мини-доступа, если в ходе оперативного вмешательства возникают технические трудности или ятрогенные осложнения.
Итак, из существующих способов лечения ЖКБ наиболее эффективным является хирургический – удаление желчного пузыря.
При плановых операциях у больных с неосложненной ЖКБ послеоперационная летальность не превышает 0,5%. Важно своевременно выявить показания к операции, не дожидаясь развития осложненных форм заболевания.
Как следует готовиться к обследованию

Врачи, назначая холеграфию, акцентируют внимание на том, что качество результатов диагностики напрямую зависит от того, насколько ответственно отнесётся обследуемый к соблюдению правил подготовки.
Алгоритм подготовки больного включает в себя обязательную бесшлаковую диету. За пять дней до назначенной даты из рациона необходимо исключить все продукты, которые усиливают газообразование в кишечнике:
- хлеб, особенно чёрный, кондитерскую выпечку;
- бобовые;
- газированные и алкогольные напитки;
- молоко и молочную продукцию;
- жирное мясо и рыбу;
- овощи и фрукты, богатые грубой клетчаткой.
За сутки доктор может провести проверку человека на чувствительность к билитрасту. Для этого ему внутривенно вводится 1 миллилитр препарата, разведённый 10 миллилитрами физраствора.
В день, который предшествует обследованию, также необходимо соблюдать некоторые требования по меню. В первой половине дня допускается кушать плотно, обычную пищу, за исключением вышеуказанных продуктов. Это необходимо, чтобы жёлчь, которая уже накопилась в пузыре, вышла из него. Обед, перекусы и ужин уже должны быть максимально лёгкими и обезжиренными, чтобы не вызывать сокращение пузыря.
Утром перед процедурой кушать и пить запрещено – холецистография проводится строго натощак.
В рамках подготовки к пероральной холецистографии, препарат с контрастом пациенту необходимо выпить за 12-14 часов. Дозировку вещества рассчитывает лечащий врач, ориентируясь на вес обследуемого. После употребления препарата, человеку необходимо улечься на правый бок, чтобы жидкость лучше всасывалась. Перед сном ставится очистительная клизма, а утром перед холецистографией её можно повторить. Контрастирующее вещество может вызвать тошноту и жидкий стул. После этого обследуемому запрещено также пить, жевать резинку и курить.
Порядок проведения диагностики жёлчного пузыря
Перед обследованием доктор-диагност делает обзорную рентгенографию области правого подреберья, чтобы оценить степень подготовленности органов пищеварения. Также выполненный снимок поможет определить теневые образования, которые могут свидетельствовать о наличии камней, газа, известковых отложений в жёлчных путях.
Алгоритм проведения процедуры состоит из двух этапов: сначала фиксируется изображение наполненного органа, потом получают снимки пузыря после опорожнения.
Пациента для осуществления снимков с контрастом укладывают на специальную кушетку, сперва в положении “на животе”. Далее доктор просит обследуемого переместиться на левый бок, встать прямо, обращая при этом внимание на расслаивание содержимого пузыря или наличие подвижных дефектов наполнения.
Тень контрастированного жёлчного пузыря выводится на центр экрана, а при отсутствии контрастного изображения – на область его проекции. Точка проекции органа расположена на пересечении наружного края прямой правой мышцы живота и дуги рёбер. Учитывая различия в размерах и положении жёлчного пузыря и печени, место проекции может отличаться.
На снимках пузырь может быть уменьшенным или увеличенным, деформированным, сморщенным, расположенным в верхней части правого подреберья, или уходящим в полость таза. Также орган может отклоняться влево или вправо, при этом его тень будет накладываться на правую почку или позвонки.
Если у обследуемого присутствует блокада жёлчного пузыря (непроходимость пузырного протока), его тень не будет визуализироваться на снимке. Кроме того, незаполненность органа контрастом может объясняться и функциональными нарушениями, например, ухудшением экскреторной функции печени.
Второй этап диагностики начинается после того, как пациенту дают желчегонную пищу или лекарство – так начинается фаза сокращения и опорожнения пузыря. Во время этого этапа доктор может оценить так называемую эвакуаторную функцию органа, а по мере того, как из него убывает контрастированная жёлчь, определить размеры и место расположения камней, рубцов или новообразований в стенках.
Общий жёлчный проток дает отображение на снимках, проделанные через 15 и 30 минут. Если функция опорожнения замедлена, последнюю фиксацию изображения производят через 60 минут.
Пропедевтика лучевых методов обследования желчного пузыря
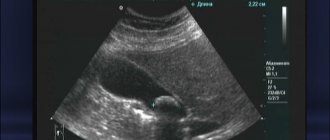
Ведущим методом диагностики патологических изменений желчного пузыря (ЖП) является ультразвуковое исследование (УЗИ).
Ультразвуковое исследование
Несомненными его преимуществами являются неинвазивность, возможность быстрого и портативного проведения исследования; отсутствие действия ионизирующей радиации и необходимости внутривенного введения контрастных веществ; независимость от физиологического состояния желудочно-кишечного тракта и гепатобилиарной системы [1–3].
Особенности синтопии желчного пузыря — прилежание его задней стенки в области тела и дна к правым отделам толстого кишечника и луковице двенадцатиперстной кишки диктуют необходимость подготовки пациентов к ультразвуковому обследованию с целью уменьшения пневматизации соответствующих отделов пищеварительного тракта. Для этого необходимо, как минимум, 6-часовое голодание накануне проведения диагностической манипуляции, а оптимальным считается проведение исследования натощак после ночного сна. Такие условия требуются еще и для наиболее детальной визуализации строения стенки желчного пузыря и его содержимого, поскольку он представляет собой полый орган, заполненный желчью и способный сокращаться в ответ на гуморальную стимуляцию при приеме пищи, что приводит к уменьшению его размеров, резкому утолщению стенок и невозможности детализировать внутрипросветные изменения [2, 3].
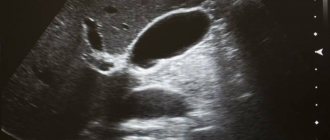
Анатомическое строение желчного пузыря несложно. В нем выделяют узкую шейку, соединяющуюся с пузырным протоком, тело пузыря, имеющее практически параллельные стенки, и куполообразное дно. В месте соединения шейки и пузырного протока стенка часто образует карман (или дивертикул) Гартмана, в котором могут скапливаться конкременты, блокирующие выход пузырной желчи [3–5] (рис. 1).
Для проведения ультразвукового исследования желчного пузыря датчик сканера (как правило, частотой 3,5 МГц) располагают в правом подреберье обследуемого — месте анатомической проекции. Улучшить визуализацию органа можно, уложив пациента на левый бок, что позволяет несколько оттеснить петли кишечника влево, этой же цели служит проведение исследование во время задержки дыхания при глубоком вдохе. Визуализация желчного пузыря через межреберья наиболее постоянна, но наименее информативна и используется в основном в ургентных ситуациях у неподготовленных пациентов. Для лучшей оценки характера внутрипузырных изменений (наличие мелких конкрементов, выявление их подвижности) возможно проведение обследования в вертикальном их положении или с наклоном туловища вперед [2–5].
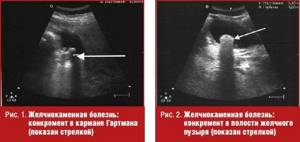
В диагностике желчнокаменной болезни (ЖКБ) ультразвуковое сканирование по праву занимает ведущие позиции. Чувствительность ультразвукового исследования при выявлении желчных конкрементов превышает 95%, которые выглядят как гиперэхогенные структуры с акустической тенью [1, 5] (рис. 2).
В подавляющем большинстве случаев конкременты подвижны, но могут быть фиксированы к стенке или неподвижно располагаться в шейке пузыря. Другими инородными телами, имитирующими холелитиаз, могут быть сгустки крови или гноя, паразиты. Полипы желчного пузыря неподвижны или ограниченно подвижны в случае наличия у них ножки, всегда связаны со стенкой и, как правило, не дают акустической тени, обычно размер их не превышает 5 мм. Как правило, на фоне длительного отсутствия сокращений пузыря возможна визуализация расслоения желчи на два компонента с четкой границей раздела, один из которых анэхогенный и занимает верхние, по отношению к горизонтальной плоскости, отделы пузыря, другой — более плотный, располагающийся снизу. Это явление, называемое застоем желчи, или сладжем (англ. «sludge» — грязь, тина, ледяная каша, ил, взвесь), возникает вследствие присутствия в ней кристаллов холестерина и билирубината кальция и их способности обратимо формировать крупные агрегаты (рис. 3).
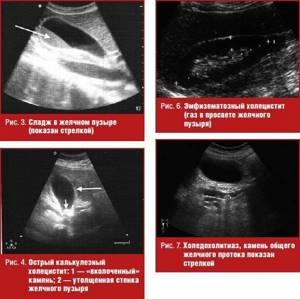
Наиболее частое осложнение желчнокаменной болезни — острый холецистит, причиной которого практически всегда является нарушение оттока желчи из желчного пузыря. Основными ультразвуковыми признаками этой патологии служат:
- наличие конкрементов в просвете пузыря (наиболее характерно обнаружение «вколоченного» конкремента в шейке) — рис. 4;
- утолщение стенки более 3 мм с появлением неоднородности ее структуры, расслоения (рис. 4);
- увеличение поперечного размера пузыря более 4 см; выявление наибольшей болезненности в месте ультразвуковой проекции желчного пузыря (ультразвуковой симптом Мерфи), которая может не определяться при гангренозном холецистите [3, 5] (рис. 4).
Сочетание указанных симптомов с обнаружением скопления жидкости около пузыря, особенно в сочетании с выявлением дефекта стенки, говорит о ее перфорации и, возможно, о формировании перипузырного абсцесса (рис. 5). Обнаружение ультразвуковых признаков скопления газа в просвете пузыря на фоне других признаков острого его воспаления указывает на такую тяжелейшую патологию, как эмфизематозный холецистит, вызываемый газообразующей анаэробной флорой [3, 5] (рис. 6).
Другое осложнение желчнокаменной болезни, проявляющееся нарушением пассажа желчи, — холедохолитиаз. Нарушение оттока желчи по общему желчному протоку вызывает его расширение более 7 мм, расширение внутрипеченочных желчных протоков (более 40% от диаметра прилежащей ветви воротной вены) (рис. 7). Бесспорным доказательством холедохолитиаза служит обнаружение конкрементов, которые чаще всего локализуются в дистальной части общего желчного протока, но могут быть визуализированы лишь в 70–80% случаев [1, 4, 5].
Расширение внутри- и внепеченочных желчных протоков отмечается и при таком осложнении желчнокаменной болезни, как синдром Мирицци (Mirizzi), который заключается в обструкции общего желчного протока в результате объемного эффекта воспалительной реакции тканей на камень, расположенный в шейке пузыря или пузырном протоке, при низком впадении его в холедох (рис. 

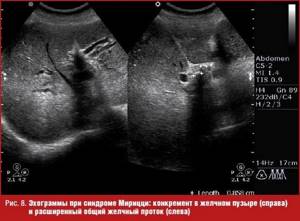
Нередко образованию конкрементов в желчном пузыре сопутствуют доброкачественные изменения его стенок, одной из основных которых выступает нарушение обмена холестерина. Эти изменения называются гиперпластической холецистопатией. Один из ее вариантов — холестериновая дистрофия проявляется такими ультразвуковыми признаками, как выявление в стенке пузыря гиперэхогенных отложений размером не более 1 мм, не дающими акустической тени, но сопровождающимися эффектом реверберации (пузырь отдаленно напоминает клубнику), которые являются липидными отложениями (рис. 9). Более выраженные изменения стенки, называемые аденомиоматозом, проявляются в ее утолщении, образовании интрамуральных дивертикулов (синусы Ашоффа–Рокитанского), содержащих гиперэхогенные холестериновые отложения с эффектом реверберации («хвост кометы») и микролиты, дающие акустическую тень (рис. 9). Гиперпластическая холецистопатия может поражать как весь пузырь, так и часть его стенки [2, 5].
Известно, что удаление ЖП по поводу ЖКБ не избавляет больных от метаболических нарушений, в том числе от гепатоцитарной дисхолии, сохраняющейся и после операции [6]. Выпадение физиологической роли ЖП, а именно концентрация желчи в печени в межпищеварительный период и выброс ее в двенадцатиперстную кишку во время еды, сопровождается нарушением пассажа желчи в кишечник и расстройством пищеварения [6, 7].
Изменение химического состава и объема желчи, хаотическое ее поступление в двенадцатиперстную кишку после холецистэктомии (ХЭ) нарушают переваривание и всасывание жира и других веществ липидной природы, уменьшают бактерицидность дуоденального содержимого, что приводит к микробному обсеменению и нарушению моторики двенадцатиперстной кишки, развитию синдрома избыточного бактериального роста в кишечнике (особенно в подвздошной кишке), расстройству печеночно-кишечной циркуляции и снижению синтеза желчных кислот в печени [6]. Как следствие — синдром нарушенного пищеварения, симптомы которого часто ошибочно трактуются как постхолецистэктомический синдром (ПХС), ассоциирующийся хирургами в первую очередь с нераспознанными до операции или не устраненными во время ХЭ механическими препятствиями желчеоттоку (оставленными или возникшими вновь камнями в холедохе, стенозом фатерова сосочка и т. д.) [6].
При подготовке к операции ХЭ большое внимание всегда уделяется диагностике механических препятствий желчеоттоку в двенадцатиперстную кишку. Совершенно иное дело обстоит с дооперационной верификацией внепеченочных билиарных дисфункций. Отсутствие косвенных признаков функциональных нарушений сфинктера Одди в виде расширения общего желчного протока при УЗИ, повышения печеночных ферментов, болевых приступов и т. д. совсем не исключает дисфункций фатерова сосочка, формирующихся задолго до поступления пациента. По нашим данным, у 45% пациентов с желчнокаменной болезнью при радионуклидной гепатобилисцинтиграфии (ГБСГ) устанавливаются функциональные нарушения транспорта радиофармпрепарата из общего желчного протока в двенадцатиперстную кишку, не требующие проведения ретроградной панкреатохолангиографии и эндоскопической коррекции.
Радионуклидные методы в ряде случаев являются просто безальтернативными из-за строгой специфичности включения радиофармпрепарата (РФП) в различные метаболические процессы (ГБСГ). Функциональное состояние гепатобилиарной системы при любой патологии гепатобилиарной системы, в том числе и при ЖКБ, изучается с помощью стандартной ГБСГ.
Гепатобилисцинтиграфия
ГБСГ позволяет объективно оценивать наиболее важные с позиций функционирования пищеварительно-транспортного конвейера процессы: желчесинтетическую и желчеэкскреторную функции печени, а также транспорт желчи в двенадцатиперстную кишку. Метод основан на регистрации пассажа короткоживущих радионуклидов Тс-99м+бромезида по билиарному тракту.
Исследование проводится натощак, в горизонтальном положении пациента после введения 3 мКм Тс-99м+бромезида внутривенно. Длительность процедуры составляет 60 минут. В качестве желчегонного завтрака пациенты принимают желтки куриных яиц или 200 мл 10% сливок через 30 минут от начала исследования.
Нормальными показателями ГБСГ считаются:
1) время полувыведения (Т1/2) радиофармпрепарата (РФП) из печени менее 35 минут; 2) время полувыведения (Т1/2) РФП из холедоха менее 50 минут; 3) время поступления РФП в двенадцатиперстную кишку менее 40 минут; 4) адекватным поступлением РФП в кишечник является преобладание активности РФП в двенадцатиперстной кишке по сравнению с таковой в холедохе к концу исследования.
Общепринятая стандартная методика радиоизотопного исследования с желчегонным завтраком не всегда позволяет конкретизировать характер функциональных изменений желчеоттока. Это объясняется тем, что пищевая нагрузка оказывает свое действие как посредством активации поступления в кровоток холецистокинина (ХК) при раздражении I-клеток слизистой оболочки двенадцатиперстной кишки и интрамурального нервного сплетения [8]. Активность пищеварительных ферментов и чувствительность сфинктерного аппарата желчевыводящих путей к интестинальным гормонам вариабельна и на практике трудноопределима [9]. Тонус интрамуральных нервных волокон зависит от физиологической активности органов верхних отделов пищеварительного тракта [10, 11].
В этой связи при радионуклидной диагностике внепеченочных билиарных дисфункций (ВБД) достаточно часто применяется внутривенное введение гормона холецистокинина, но релаксирующий эффект этого препарата зависит от состояния центральной нервной системы, гормонального фона пациента и нарушается при холестерозе ЖП, поскольку локализация рецепторов к холецистокинину совпадает с местами отложений эфиров холестерина в стенке пузыря и желчных протоках, что затрудняет точное определение дозы вводимого гормона [8, 10].
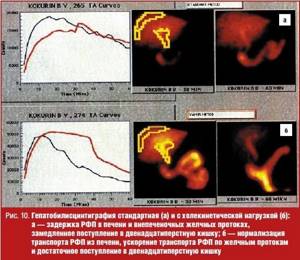
Для уточнения характера нарушений желчеоттока по общему желчному протоку в клинике факультетской хирургии им. С. И. Спасокукоцкого РНИМУ им. Н. И. Пирогова на базе Первой Градской больницы выполняются ГБСГ с аминокислотным холекинетическим тестом (ГБСГ-АХТ) и ГБСГ с Бускопан®-тестом (патент РФ № 2166333).
ГБСГ с аминокислотным холекинетическим тестом
Исследование проводится натощак. Через 30 минут после введения РФП и начала исследования в периферическую вену вводится раствор аминокислот Вамин-14 или Фреамин, не содержащие глюкозы и электролитов. Последнее условие мы считаем весьма важным, так как возникающая при инфузии глюкозы гипергликемия полностью или частично ингибирует секрецию холецистокинина [8]. Доза препарата выбиралось из расчета 1,5–2 мл/кг массы тела (80–130 мл). Продолжительность инфузии составляет 5–7 минут, поскольку введение раствора аминокислот более 10 минут (независимо от дозы) не приводит к увеличению выброса эндогенного холецистокинина, а наоборот, снижает инкрецию гормона [9]. ВБД и причина замедленной экскреции радиофармпрепарата гепатоцитами оценивается на основании различий показателей стандартной ГБСГ и ГБСГ-АХТ (рис. 10).
ГБСГ с использованием гиосцина бутилбромида
Гиосцина бутилбромид (Бускопан®) — производное третичного аммониевого соединения гиосцина. Гиосцин — алкалоид, присутствующий в растении рода Duboisia. Его химически перерабатывают с помощью добавления бутиловой группы для получения четвертичной аммониевой структуры. Эта модификация формирует молекулу, которая по-прежнему обладает антихолинергическими свойствами, сравнимыми со свойствами гиосцина.
Но, в отличие от гиосцина, четвертичные аммониевые соединения, такие как гиосцина бутилбромид, ограничивают системное поглощение и значительно уменьшают число побочных реакций. Гиосцина бутилбромид — антихолинергический препарат с высокой степенью сродства к мускариновым рецепторам, расположенным на клетках гладких мышц желудочно-кишечного тракта, вызывает спазмолитический эффект. Кроме того, препарат связывается с никотиновыми рецепторами, что определяет эффект блокировки нервных узлов, что обуславливает его антисекреторное действие.
Техническая сторона исследования мало отличается от вышеизложенного АХТ-теста. По окончании стандартной гепатобилисцинтиграфии пациент вместо инфузии раствора аминокислот принимает per os 20 мг гиосцина бутилбромида. Через 20 минут выполняется повторная запись и обработка данных (рис. 11). Таким образом, применение Бускопан®-теста позволяет сократить время диагностики для врача и упрощает диагностическую процедуру для пациента.
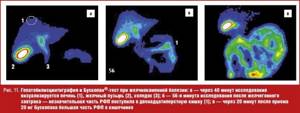
Наиболее эффективно ГБСГ с Бускопан®-тестом зарекомендовала себя при исследовании пациентов после холецистэктомии (рис. 12).
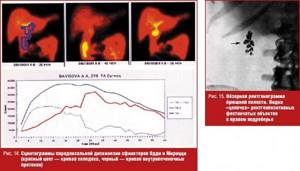
Ведущими факторами нарушения функции печени после холецистэктомии являются наличие и продолжительность дискинезии сфинктерного аппарата желчных путей. У пациентов значительно преобладает парадоксальный спазм сфинктера Одди как причина задержки РФП в холедохе. Функциональные нарушения оттока желчи обусловлены холестерозом желчных путей, в частности сфинктера Одди (рис. 13, 14).
Рентгенологические методы
Рентгенологические методы исследования желчного пузыря и внепеченочных желчных протоков сегодня практически не применяются, поэтому приводим их краткое описание в качестве исторической справки.
Обзорная рентгенография
Обзорная рентгенография брюшной полости проводится намного реже, чем УЗИ, из-за лучевой нагрузки. Но, тем не менее, она являлась достаточно информативным методом диагностики желчекаменной болезни. На рентгенограмме можно увидеть наличие, месторасположение и количество рентгенпозитивных камней, содержащих соли кальция (рис. 15).
Пероральная холецистография
Пероральная холецистография проводится при подозрении на рентгеннегативные (холестериновые) камни. Метод основывается на всасывании в желудочно-кишечном тракте и выведении с желчью контрастного вещества (рис. 16).
При нарушении всасывания в кишечнике, снижении выделительной функции печени, закупорке пузырного протока камнем и прочем пероральная холецистография может быть отрицательной, т. е. на ней не определяется тень желчного пузыря.
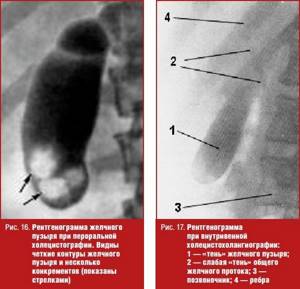
Внутривенная холецистография
Внутривенная холецистография выполняется при отрицательном результате перорального рентгеноконтрастного метода. С помощью данной методики удается контрастировать желчный пузырь в 80–90% случаев (рис. 17).
Компьютерная томография и магнитно-ядерная (магнитно-резонансная) томография
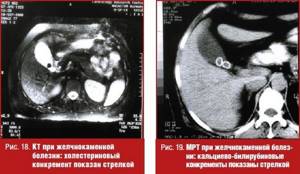
Недостатки классических рентгенологических исследований желчного пузыря с успехом восполняют компьютерная томография (КТ) и магнитно-ядерная томография (магнитно-резонансная томография, МРТ). При калькулезном холестерозе конкременты визуализируются в виде теней однородной структуры (холестериновые камни) (рис. 18) или представлены неоднородными тенями с чередованием участков смешанных камней — холестериновое ядро с кальциево-билирубиновой оболочкой (рис. 19).
Компьютерная томография и магнитно-ядерная томография позволяют заподозрить желчекаменную болезнь у пациентов, обследуемых по поводу другой патологии органов брюшной полости, так как описание изображения желчного пузыря является обязательной составляющей протокола этих исследований.
Литература
- Практическое руководство по ультразвуковой диагностике. Под ред. В. В. Митькова. М.: Видар-М, 2003. Т. 1. 720 с.
- Brant W. E., Helms C. A. Fundamentals of Diagnostic Radiology, 2 nd ed. Lippincott, Williams and Wilkins, p. 836–841.
- Kurtz A. B., Middleton W. D. Ultrasound: The Requisites. Philadeiphia, Hanley&Belfus, 1996, p. 35–71.
- Parulekar S. G. Transabdominal sonography of bile ducts // Ultrasound Q. 2002, (18) 3: 187–202.
- Rumack C. M., Wilson S. R., Charboneau J. W. (eds). Diagnostic Ultrasound, 2 nd ed. St. Louis, Mosby, 1998, p. 172–195.
- Савельев В. С., Петухов В. А. Желчекаменная болезнь и синдром нарушенного пищеварения. М.: БОРГЕС, 2010. 258 с.
- Савельев В. С., Петухов В. А., Болдин Б. В. Холестероз желчного пузяря. М.: ВЕДИ, 2002., 176 с.
- Высоцкая Р. А. Простагландины и гастроинтестинальные гормоны при хронических заболеваниях печени. Дисс. докт. биол. наук. М., 1992, 340 с.
- Houda R., Tooli J., Dodds W. J. Effect of enteric hormons on sphincter of Oddi and gastrointestinal myoelectric activity in fasted conscious opossums // Gastroenterol. 1983, vol. 84, p. 1–9.
- Weechsler-J. G. Bedeutung der Gallenblase in der Regulation des duodenogastralen Refluxes // Z-Gastroenterol. 1987, Aug. 25, Suppl 3: p. 15–21.
- Петухов В. А. Липидный дистресс-синдром. Под ред. В. С. Савельева, М.: МАКС ПРЕСС, 2010. 544 с.
В. А. Петухов*, 1, доктор медицинских наук, профессор Д. А. Чуриков**, кандидат медицинских наук
* ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва ** ГУЗ ГКБ № 1 им. Н. И. Пирогова, Москва
1 Контактная информация