Больная К, 69 лет.
Диагноз
: опухоль левой почки T1aNoMx. Киста левой почки.
Клинические проявления заболевания:
боль в поясничной области слева.
История настоящего заболевания:
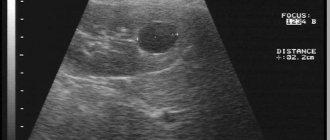
в 1998 г. по месту жительства при УЗИ выявлено образование левой почки. Периодически обследовалась, отмечено увеличение образования в размерах.
По данным мультиспиральной компьютерной томографии в среднем сегменте левой почки по задней поверхности определяется образование овальной формы неоднородной структуры, размером 25х12 мм, активно накапливающее контрастный препарат; к образованию тесно прилежит киста размером 65х66 мм.
Госпитализирована в клинику урологии Первого МГМУ им. И.М. Сеченова для дообследования и оперативного лечения.
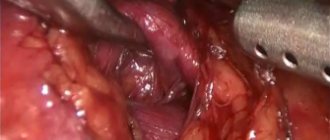
С целью избавления пациентки от опухоли левой почки, предотвращения прогрессирования опухолевого процесса, а также с целью избавления пациентки от кисты левой почки выполнена лапароскопическая (ретроперитонеоскопическая) резекция левой почки с опухолью и резекция стенок кисты левой почки.
ВИДЕО
Описание видео:
операция выполняется без пережатия почечных сосудов (в условиях zero ишемии). Страховой дренаж не устанавливался. Длительность операции 40 мин. В отделение реанимации и интенсивной терапии не находилась. Послеоперационный период протекал без особенностей. На третьи сутки пациентка выписана в удовлетворительном состоянии домой. Швы удалены на седьмые сутки амбулаторно.
Гистологическое заключение:
в препаратах светлоклеточный почечно-клеточный рак (G1) с инвазией в корковый слой почки. Хирургический край отрицательный.
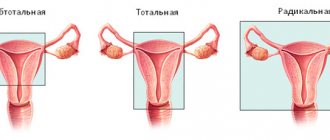
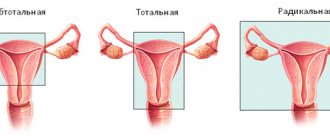
Что такое резекция почки?
Резекция почки (от лат. resectio — отсечение) – удаление части почки (другие названия этой операции: частичная нефрэктомия, парциальная нефрэктомия), пораженного каким-либо патологическим процессом (опухолью, реже — камни, кисты, травмы, туберкулез и т.д.), в пределах здоровых тканей (т.е. опухоль максимально удаляется, при этом хирург немного заходит на здоровые ткани).
На сегодняшний день классическая открытая резекция отошла на второй план, на лидирующие позиции вышла ее современная малоинвазивная альтернатива – лапароскопическая резекция, о которой и пойдет речь далее, а именно о показаниях, противопоказания, технике выполнения и т.д.
Стоимость лапароскопической резекции почки
Операция выполняется по полису ОМС или по квоте в зависимости от объема и вида операции.
Кому показана лапароскопическая резекция почки?
Наиболее эффективна резекция почки, при локализованном раке (опухоль не прорастает в соседние органы или капсулу почки), небольшом размере опухоли (не более 4 см) и единичном опухолевом узле. Чаще всего операцию выполняют на стадиях T1 и Т2. При таких параметрах опухоли риск развития рецидива после оперативного вмешательства крайне мал и составляет менее 10%.
Помимо вышесказанного резекцию почки выполняют в тех случаях, когда удаление почки оставит пациента без обеих почек, либо потребует незамедлительного начала диализа.
Такая ситуация возможна при:
- двустороннем раке почек (если обе почки поражены опухолью),
- раке единственной почки (врожденное отсутствие почки или после оперативного удаления),
- единственной функционирующей почки (т.е. несмотря на наличие обеих почек, одна из них утратила свою функцию по каким-либо причинам),
- при заболеваниях почки (которая не поражена опухолью) потенциально угрожающих ее функции (т.е. если с одной стороны почка поражена опухолью, а с противоположной имеется заболевание, которое в последствием может или приведет к потере ее функции).
Лапароскопическая нефрэктомия
Существует достаточно большое количество заболеваний, при которых может быть показано удаление почки в плановом порядке. Самые частые из них — это рак почки, гидронефроз и мочекаменная болезнь. Злокачественные опухоли большого размера (обычно более 5 см), или расположенные в толще почки, вблизи крупных сосудов, не позволяют выполнить удаление опухоли с сохранением органа. Гидронефроз – заболевание, развивающееся вследствие длительного нарушения оттока мочи из почки. В результате почка перестаёт выделять мочу, её паренхима истончается. Такой орган не выполняет никакой функции, но зато может быть источником хронического воспаления, вызывать боль, повышение артериального давления. Это запущенная мочекаменная болезнь, когда хроническое воспаление в почке приводит к её сморщиванию.
Какие имеются противопоказания к лапароскопической резекции почки?
Как и все лапароскопические операции резекция почки имеет общий список противопоказаний, при которых проведение операции сопряжено с высоким риском таких осложнений, как кровотечение, либо проведение оперативного пособия будет затруднительно.
Резекция противопоказана при:
- крайней степени ожирения,
- нарушении работы свертывающей системы крови,
- при инфекционных заболеваниях,
- на поздних сроках беременности.
Острые воспалительные процессы в связи с большой вероятностью инфицирования брюшной полости также являются противопоказанием к лапароскопической резекции. Наличие рубцов в брюшинной полости от ранее выполненных операций вызывает значительные технические трудности при выделении почки и ее окружающих тканей, что значительно затрудняет или делает лапароскопическое вмешательство невозможным.
Классификация
В настоящее время в России и в большинстве стран мира используется классификация TNM (Т-tumor, N-node, M-metastasis).
- Т — первичная опухоль ТХ — первичная опухоль не может быть оценена
- Т0 — нет данных о первичной опухоли
- Т1 — опухоль не более 7 см в наибольшем измерении, ограниченная почкой
- T1a — опухоль до 4 см
- T1b — опухоль 4-7 см
- Т2 — опухоль более 7 см в наибольшем измерении, ограниченная почкой
- Т3 — опухоль распространяется в крупные вены, или инвазирует надпочечник, или окружающие ткани, но не выходит за пределы фасции Герота
- Т3а — опухолевая инвазия надпочечника или паранефральной клетчатки впределах фасции Герота
- Т3b — опухоль распространяется в почечную вену или нижнюю полую вену ниже диафрагмы
- Т3с — опухоль распространяется в нижнюю полую вену выше диафрагмы или инвазирует ее стенку.
- Т4 — Опухоль распространяется за пределы фасции Герота
- N — регионарные лимфатические узлы NX — регионарные лимфатические узлы не могут быть оценены
- N0 — нет метастазов в регионарных лимфатические узлах
- N1 — метастаз в одном регионарном лимфатическом узле
- N2 — метастазы более чем в одном регионарном лимфатическом узле
- М — отдаленные метастазы МХ — отдаленные метастазы не могут быть оценены
- М0 — нет отдаленных метастазов
- М1 — отдаленные метастазы
- G — гистопаталогическая градация GX — степень дифференцировки не может быть оценена
- G1 — высоко дифференцированная опухоль
- G2 — умеренно дифференцированная опухоль
- G3-4 — низкодифференцированная/ недифференцированная опухоль
Группировка по стадиям
| Стадия I | Т1 | N0 | M0 |
| Cтадия II | T2 | N0 | M0 |
| Стадия III | T1 | N1 | M0 |
| Т2 | N1 | M0 | |
| T3 | N0, N1 | M0 | |
| Стадия IV | T4 | N0, N1 | M0 |
| любая Т | N2 | M0 | |
| любая Т | любая N | M1 |
Как подготовиться к операции?
Перед операцией в обязательном порядке вас консультируют специалисты различных профилей – анестезиолог, терапевт, хирург, а также при необходимости и другие. После этого ваш лечащий врач дает индивидуальные рекомендации, которым вы должный строго следовать – не есть, не пить за несколько часов до операции и т.д.
Обязательно нужно сообщить об аллергиях на препараты, а также о том, какие вы принимаете лекарства, во избежание осложнений во время операции (особенно это касается препаратов, разжижающих кровь, что может вызвать серьезное кровотечение как во время операции, так и после нее).
Перед операцией проводят тщательную подготовку кишечника, назначают антимикробные препараты широкого спектра действия для предотвращения инфекционных осложнений в послеоперационном периоде.
Как выполняется лапароскопическая резекция почки?
Операция проводится под общим наркозом (происходит погружение в сон на протяжении всей операции). Пациент укладывается в специальное положение – на здоровом боку, при этом операционный стол разгибают, приближая, тем самым, почку к передней брюшной стенке. Доступ к почке осуществляется при помощи 3-4 маленьких отверстий около 1 см на передней брюшной стенке, через них вводится специальная камера (лапароскоп) и другие необходимые хирургические инструменты. Одно из отверстий впоследствии немного продлевают, для того чтобы можно было достать пакет с опухолью из брюшной полости.
Лапароскоп в несколько раз увеличивает размер операционного поля, что позволяет хирургу работать точнее и аккуратнее. Это необходимо при резекции почки, так как резекция, в отличии от удаления почки, технически более сложная манипуляция требующая более точных и аккуратных действий. Для увеличения рабочего пространства в брюшной полости, в нее вводят углекислый газ (создают пневмоперитонеум), который полностью выводится в конце операции.
После создания пневмоперитонеума вводится лапароскоп и осматривается брюшная полость. Далее хирург начинает выделять почку, для этого он рассекает ткани и отводит органы в стороны. После выделения и осмотра почки начинается этап выделения сосудов и мочеточника, затем хирург пережимает почечную артерию специальным зажимом для обеспечения минимальной кровопотери во время операции.
После этого начинается самый ответственный этап – непосредственно резекция, которая выполняется в условиях ишемии почки (как было сказано ранее, почечная артерия пережата, следовательно, к почке не поступает артериальная кровь, что может привести к ее гибели, если время ишемии будет больше 40 минут). В среднем, время ишемии составляет около 10–15 минут, что является абсолютно безопасным для почки и никак не влияет на ее функции.
После удаления участка почки с опухолью, края почки сшиваются и снимается зажим с артерии. Производится осмотр брюшной полости и ложа удаленной опухоли на предмет наличия кровотечения, опухоль укладывается в специальный пакет и удаляется из брюшной полости. Затем хирург извлекает инструменты и сшивает ткани. В среднем длительность операции варьируется от 2 до 3 часов.
Заболеваемость почечно-клеточным раком (ПКР) в последние годы устойчиво возрастает. В настоящее время прирост показателя заболеваемости составляет около 3% ежегодно. При этом наибольший прирост отмечается за счет увеличения числа больных с локализованными опухолями, что обусловлено улучшением методов диагностики [2, 11]. Так, согласно европейской базе данных SEER (Surveillance, Epidemiology, and End Results) с 1988 по 2002 г. средний размер опухоли почки уменьшился с 67 до 59 мм. При анализе большой когорты больных, оперированных в европейских странах, выявили, что за период наблюдения в 1995—2005 гг. количество оперативных вмешательств, выполняемых по поводу ПКР, увеличилось от 6,2 до 7,5 на 100 000 пациентов, при этом доля опухолей T1 увеличилась с 36,6 до 44,2%, а доля распространенного ПКР уменьшилась с 46,4 до 33,7% [10]. Количество больных с опухолью менее 4 см в диаметре увеличилось от 30 до 39%. Выявленные тенденции, несомненно, привели к улучшению показателей выживаемости в этих группах ПКР [11]. В связи с миграцией стадии в сторону локализованного ПКР с опухолью маленького размера за последние 2 десятилетия произошло постепенное изменение основного хирургического метода лечения в этой группе больных. Радикальную нефрэктомию, считавшуюся ранее «золотым» стандартом лечения локализованного ПКР Т1—2 стадии, сменила органосохраняющая резекция почки в различных вариантах доступа: стандартном, лапароскопическом или роботоассистированном. Лапароскопическая резекция почки (ЛРП) в последнее время стала стандартом лечения в клиниках, обладающих значительным опытом лапароскопической хирургии при экзофитной опухоли почки небольшого размера (менее 2,5—3,0 см). Основными недостатками ЛРП являются трудности в обеспечении надежного интраоперационного гемостаза и необходимость создания ишемии почечной ткани.
В настоящей работе представлены промежуточные результаты применения новой методики ЛРП с использованием радиочастотной абляции (РЧА) без ишемии у больных ранним ПКР.
Материалы и методы
Мы использовали оснащение и стандартный набор инструментов, необходимых для выполнения лапароскопических операций, включающий лапароскопическую стойку, инсуффлятор, видеокамеру, видеомонитор, световод, источник света, аппарат для монополярной и биполярной коагуляции, аппарат для биполярной коагуляции «ЛигаШу», ирригационно-отсасывающее устройство, лапароскопический УЗ-датчик. Инструментарий: игла Вереша, одноразовые троакары различных размеров, режуще-коагулирующие ножницы, зажимы, диссекторы, иглодержатели, лапароскопический сосудистый зажим, веерообразный ретрактор, клипатор, электроды для моно- и биполярной коагуляции, набор атравматического шовного материала, лапароскопический контейнер для удаления препарата. При ЛРП с применением РЧА использовали монополярную установку Cool-Tip RF с одноигольчатым зондом (17 G., длина 20 см, рабочая поверхность 20 мм) и набором пассивных электродов.
Всем больным перед операцией выполняли ультразвуковое исследование (УЗИ) и компьютерную томографию (КТ) органов брюшной полости и забрюшинного пространства, при помощи которых оценивали точное расположение опухоли, отношение к почечным сосудам и чашечно-лоханочной системе (ЧЛС).
Положение больного на операционном столе – на боку (противоположном почке, в которой локализовалась опухоль), на уровне мечевидного отростка укладывали валик. Операцию выполняли из трансабдоминального доступа. После создания пневмоперитонеума в брюшную полость устанавливали 3 троакара (+1 для ретрактора при необходимости тракции печени): I — 10-милиметровый троакар — в околопупочной области (по латеральному краю прямой мышцы живота), II — 10-миллиметровый троакар — по среднеключичной линии ниже реберной дуги, III — 10-миллиметровый троакар — по среднеключичной линии выше передневерхней ости подвздошной кости.
В I порт вводили лапароскоп и производили видеоревизию брюшной полости, в порты II и III — инструменты.
Этапы и методология стандартной лапароскопической и открытой резекции почки принципиально не отличаются. После ревизии брюшной полости выполняли мобилизацию почки и почечных сосудов. Затем с помощью моно- и биполярной коагуляции рассекали паранефральную клетчатку вокруг опухоли. Клетчатку непосредственно над опухолью оставляли. В случае интрапаренхиматозного роста опухоли и при опухолях неправильной формы, располагающихся в центральных отделах, проводили лапароскопическое интраоперационное УЗИ почки, позволяющее уточнить размер, локализацию и структуру опухоли, а также ее отношение к ЧЛС.
Стандартную лапароскопическую резекцию почки выполняли на этапе освоения ЛРП, а также в последующем при сложных случаях, опухоли большого размера, интрапаренхиматозной опухоли и при опухоли неправильной формы с центральным расположением.
ЛРП с использованием РЧА без ишемии выполняли при удобном для резекции расположении опухоли: экстраорганном расположении в нижнем или верхнем полюсе, по передней поверхности почки и в отсутствии близости к ЧЛС.
Стандартную ЛРП начинали с формирования линии предполагаемой резекции ножницами с монополярной коагуляцией. Создавали ишемию почки путем пережатия почечной артерии или всей почечной ножки с помощью лапароскопического интракорпорального сосудистого зажима. В некоторых случаях при небольшой поверхностной опухоли оперативное вмешательство выполняли без пережатия почечных сосудов. Резекцию почки выполняли с помощью «холодных» ножниц и отсоса, используемого для диссекции паренхимы и улучшения визуализации краев резекции. Граница резекции располагалась не менее чем в 5 мм от краев опухоли. После визуальной ревизии дна и краев раны при необходимости проводили коагуляцию отдельных сосудов монополярным шариковым электродом. При вскрытии ЧЛС выполняли ее ушивание атравматической рассасывающейся нитью. В дефект почечной паренхимы помещали гемостатическую сетку или ватку Surgicel, над которой сшивали почечную паренхиму атравматическими швами (викрил 3,0). После завершения ушивания паренхимы почки лапароскопический сосудистый зажим с почечной артерии или ножки снимали и проверяли надежность гемостаза. Удаленный препарат (участок резецированной почки с опухолью и прилегающей к ней паранефральной клетчаткой) помещали в контейнер и удаляли через минилапаратомный 2—3 см разрез в месте расположения инструментального троакара. Паранефральную клетчатку над зоной резекции ушивали атравматическими швами (викрил 3,0). Заканчивали операцию дренированием забрюшинного пространства.
При ЛРП с использованием РЧА мобилизацию почечных сосудов не выполняли. Пережатия почечной ножки не проводили. По предполагаемой линии резекции под визуальным и/или УЗ-контролем производили введение зонда отступив 5—7 мм от края опухоли (рис. 1).
Рисунок 1. РЧА по линии предполагаемой резекции почки. Время абляции каждой точки зависело от сопротивления ткани и в среднем составляло около 2 мин. Резекцию почки выполняли по стандартной методике без ишемии почечной ткани.
В случае неполного гемостаза по линии резекции выполняли дополнительную абляцию почечной ткани. После удаления препарата и визуальной оценки краев резекции ушивания паренхимы почки не проводили (рис. 2).
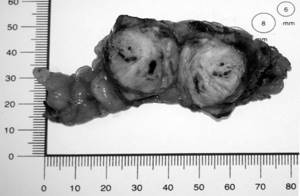
Рисунок 2. Вид удаленного препарата, фрагмент паренхимы почки с опухолью и прилегающей паранефральной клетчаткой после ЛРП с РЧА. Паранефральную клетчатку над зоной резекции ушивали атравматическими швами (викрил 3,0). Заканчивали операцию дренированием забрюшинного пространства.
В отделении онкоурологии МНИОИ им. П.А. Герцена в период с 2003 по 2011 г. выполнено 122 ЛРП. Все оперативные вмешательства выполнены одним хирургом. Из 122 оперированных больных были 74 (60,6%) мужчины и 48 (39,4%) женщин. Средний возраст больных составил 53,8±11,6 года (16—79 лет). Опухоль правой почки диагностирована у 62 (50,8%) больных, левой — у 59 (48,4%) и обеих почек — у 1 (0,8%) пациента. ЛРП по поводу опухоли единственной почки выполнена 5 (4%) больным. Средний диаметр опухоли, по данным предоперационного обследования, составил 29,5±11,4 мм (10—80 мм). Расположение опухоли у 81 (66,4%) больного было преимущественно экстраорганное и у 41 (33,6%) с интрапаренхиматозным ростом. Распределение опухолей по сегментам было сопоставимое: в среднем сегменте почки локализовались 42 (34,4%) опухоли, в верхнем и нижнем сегментах — 41 (33,6%) и 39 (32%) соответственно. Общая частота побочных эффектов составила 14,75% (18 больных). После стратификации больных на группы в зависимости от методики оперативного вмешательства провели их сравнение. Для статистической обработки данных применяли программу Statistica 8.
Результаты
У 51 (41,8%) больного выполнена стандартная ЛРП и у 71 (58,2%) — ЛРП с применением РЧА. При сравнении групп по основным предоперационным показателям выявлено, что группы сопоставимы по среднему возрасту, размеру опухоли, локализации опухоли и гендерному составу популяции (р>0,05) (табл. 1).

Средний возраст больных составил 53,1±11,6 года (27—75 лет) в группе стандартной ЛРП и 54,4±11,6 года (16—79 лет) в группе ЛРП с РЧА. Средний размер опухоли составил 31,7±11,5 мм (10—60 мм) в группе стандартной ЛРП и 28,1±11,2 (11—80 мм) в группе ЛРП с РЧА. В обеих группах преобладали больные с экстраорганным расположением опухоли — 32 (62,7%) пациента в группе стандартной и 49 (69%) в группе ЛРП с использованием РЧА, что являлось одним из критериев отбора в группы. При этом достоверных различий по локализации опухоли в различных сегментах не выявлено.
При сравнении по основным послеоперационным показателям выявлено отсутствие статистически достоверных различий по времени оперативного вмешательства, продолжительности койко-дня, частоте осложнений и времени наблюдения (р>0,05) (табл. 2).

Достоверные различия выявлены только по степени кровопотери и размеру удаленной опухоли согласно данным патоморфологического заключения. Отмечена тенденция к уменьшению времени оперативного вмешательства в группе больных, которым выполнили ЛРП с РЧА. Среднее время операции составило 137,8±60,8 мин (60—360 мин) для группы стандартной ЛРП и 117,1±30,2 мин (75—200 мин) при ЛРП с применением РЧА (p>0,05). Медиана кровопотери при выполнении ЛРП с применением РЧА оказалась достоверно ниже и составила 100 мл, при этом показатели кровопотери в группе варьировали от 50 мл до 1100 мл, в то время как в группе стандартной ЛРП медиана кровопотери составила 300 мл (50—2800 мл), р<0,001. Послеоперационный койко-день варьировал от 6 до 14 дней в группе стандартной ЛРП и от 5 до 21 дня в группе больных, которым выполнили ЛРП с РЧА, при этом медиана в обеих группах была сопоставима и составила 8 дней (p>0,05).
В 104 (85,2%) случаях оперативное вмешательство прошло без осложнений. У 18 (14,8%) больных возникли интра- или послеоперационные осложнения. По частоте встречаемости интра- и послеоперационных осложнений группы оказались сопоставимы. Осложнения составили 11,8% (6 больных) в группе стандартной ЛРП и 16,9% (12 больных) в группе ЛРП с применением РЧА (табл. 3).
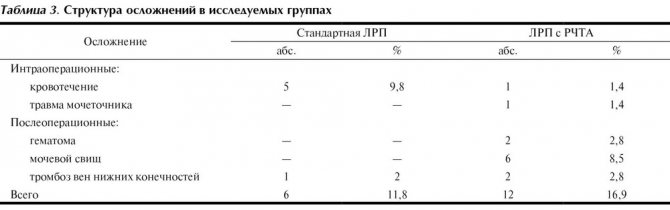
Осложнения преимущественно встречались на этапе освоения методики. В группе пациентов стандартной ЛРП 4 (7,8%) больным выполнили конверсию из-за развившегося кровотечения, в группе ЛРП с РЧА конверсии не проводилось, что обусловлено более поздним освоением методики и набором опыта лапароскопических операций.
К основным осложнениям у пациентов, которым проводили ЛРП с использованием РЧА, относили формирование мочевого свища у 6 (8,5%) больных в раннем послеоперационном периоде, гематому у 2 (2,8%) больных, травму мочеточника, потребовавшую стентирования и ушивания мочеточника атравматической нитью, у 1 (1,4%) и повреждение нижней полой вены, что привело к большей кровопотере (1100 мл) и потребовало клипирования дефекта, у 1 (1,4%) больного. Мочевые свищи закрывали консервативно, выполняя стентирование мочеточника. Одному из 2 больных с гематомой потребовалось дренирование. Относительно высокая частота мочевых свищей в нашем наблюдении обусловлена тем, что первоначально ЛРП с РЧА применяли у значительной группы пациентов, в том числе у больных с опухолями, близко расположенными к ЧЛС. После пересмотра показаний к применению данной методики мочевых свищей в последней выборке больных не наблюдается. При анализе взаимосвязи между частотой осложнений и расположением опухоли почки (интрапаренхиматозное или экстраорганное) выявлена слабая статистически достоверная корреляция: (коэффициент корреляции R=0,25; метод Спирмена; р<0,01). Достоверной корреляции между вероятностью осложнений и локализацией опухоли в том или ином сегменте почки не выявлено (коэффициент корреляции R=0,15; метод Спирмена; р≥0,05). При оценке возможности влияния размера опухоли на вероятность осложнений корреляции также не выявлено.
После получения планового гистологического заключения выявлены статистически достоверные различия в размере удаленной опухоли почки. Средний размер опухоли в группе стандартной ЛРП составил 28,6±11,6 мм (10—70 мм), в группе ЛРП с РЧА — 24,1±12,9 мм (5—85 мм). Больший размер опухоли в популяции больных, которым выполняли стандартную ЛРП, обусловлен отбором больных и необходимостью выполнения оперативного вмешательства в условиях аноксии ввиду большего размера опухоли, близости ЧЛС и большей вероятности возникновения осложнений. В группе стандартной ЛРП оперативное вмешательство с аноксией паренхимы почки выполнено 25 больным, при этом среднее время аноксии составило 21,6±8,7 мин (8—40 мин). Время наблюдения в обеих группах достоверно не различалось, но было несколько более продолжительным в группе стандартной ЛРП, что связано с более поздним временем разработки методики ЛРП с РЧА. Среднее время наблюдения в группе стандартной ЛРП составило 49,3±40,2 мес (1—102 мес), а в группе ЛРП с РЧА — 31,7±16,7 мес (1—63 мес).
По данным патоморфологического исследования у 77 (63%) пациентов выявлен светлоклеточный вариант ПКР, у 16 (13%) — папиллярный вариант, у 13 (11%) — хромофобный, у 3 (2%) — смешанный вариант ПКР и у 13 (11%) — доброкачественные опухоли почки (рис. 3).
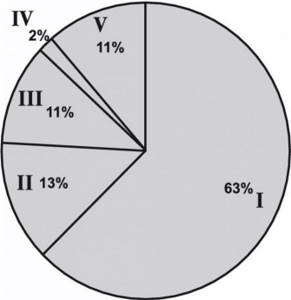
Рисунок 3. Варианты гистологического строения опухолей почки. I — светлоклеточный; II — папиллярный; III — хромофобный; IV — смешанный; V — доброкачественные образования. В нашем исследовании среди доброкачественных опухолей верифицированы: онкоцитома — у 3 (2%) больных, ангиомиолипома — у 5 (4,5%), киста почки — у 5 (4,5%) пациентов. Распределение больных по стадиям опухолевого процесса представлено на рис. 4.
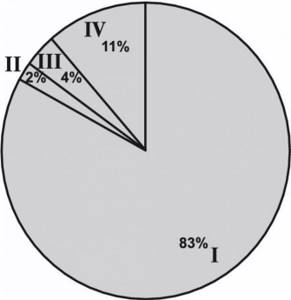
Рисунок 4. Распределение больных по стадиям опухолевого процесса. I — pT1aN0M0; II — pT1bN0M0; III — pT3aN0M0; IV — доброкачественные образования. Согласно патоморфологическому заключению стадия pT1aN0M0 верифицирована у 101 (83%) больного, стадия pT1bN0M0 — у 3 (2%) и стадия pT3bN0M0 — у 5 (4%) больных. На 7-е сутки средний послеоперационный уровень креатинина составил 101,2 мкМ/л (70—156) в группе стандартной ЛРП и 121,9 мкМ/л (72—277) в группе ЛРП с РЧА.
За время наблюдения местных рецидивов и прогрессирования заболевания не выявлено, в настоящее время все пациенты живы с хорошей функцией почек. Ни тепловой, ни холодовой ишемии при выполнении ЛРП с РЧА не проводили. Ни в одном случае не наблюдали положительного хирургического края.
Обсуждение
Широкое применение в клинической практике современных методов диагностики (УЗИ, КТ, МРТ) позволяет в настоящее время выявлять все большее количество бессимптомных, небольших по размеру опухолей почки.
В связи с миграцией стадии в сторону локализованного ПКР основным методом лечения этой группы больных стали органосохраняющие операции, такие как резекция почки в различных вариантах: стандартная, лапароскопическая или роботоассистированная. Онкологические результаты при выполнении резекции почки не отличаются от результатов радикальной нефрэктомии, в то же время органосохраняющие операции характеризуются лучшими функциональными результатами, особенно у больных с исходным нарушением функции почек, единственной функционирующей почкой или наличием сопутствующей урологической патологии. Именно по этой причине органосохраняющие операции при опухолях почек, в том числе ЛРП, в последнее время являются наиболее перспективным методом хирургического лечения больных ПКР с небольшими (менее 4 см, стадия Т1а) опухолями почек [1]. Несмотря на привлекательность концепции малоинвазивного и малотравматичного вмешательства при опухоли почки малого размера, ЛРП в большинстве клиник не применяется как стандартный метод хирургического лечения больных ПКР [1, 12]. Сомнения в эффективности ЛРП обусловлены техническими трудностями в осуществлении надежного гемостаза во время операции и неуверенностью в радикализме вмешательства. Тем не менее в крупных онкоурологических клиниках уже накоплен достаточный опыт ЛРП, позволяющий оценить преимущества и недостатки метода в сравнении с резекцией почки открытым доступом [3, 8, 9]. Низкая травматичность лапароскопического доступа при резекции почки, лучший косметический эффект, сокращение сроков госпитализации и количества используемых в послеоперационном периоде анальгетиков являются несомненными преимуществами данного метода по сравнению с открытой операцией.
Ишемия почечной паренхимы не является обязательным условием, позволяющим осуществить оперативное вмешательство, но она способствует уменьшению кровопотери и облегчает манипуляции на почке, особенно при опухолях с интрапаренхиматозным распространением. B. Guillonneau и соавт. [10] отмечают статистически значимое уменьшение среднего объема кровопотери в группе больных, которым выполняли пережатие почечной артерии во время ЛРП (270,3±281 мл), по сравнению с больными, которым выполняли резекцию без ишемии (708,3±569 мл). При этом продолжительность операции в группе с временным прекращением почечного кровотока также оказалась меньше, чем в группе больных без пережатия артерии — соответственно 60—120 мин (в среднем 121,5±37 мин) в 1-й группе и 90—390 мин (в среднем179,1±86 мин) во 2-й группе, р=0,004. Длительность ишемии почки в данном исследовании составила 15—47 мин (в среднем 27,3±7 мин), что не приводило к существенному ухудшению почечной функции после операции, средний уровень креатинина сыворотки составил 1,45±0,61 мг/Дл (128±54 мкМ/л) [10]. Другие исследования также подтверждают, что пережатие почечной артерии во время ЛРП почки приводит к более эффективному гемостазу, снижает интраоперационную кровопотерю и облегчает манипуляции на почке. В то же время J. Rassweiler и соавт. [13] считают целесообразным накладывать зажим на почечную ножку только при новообразованиях более 2 см или при значительной интраренальной экстензии опухоли. При небольших «экзофитных» опухолях авторы выполняли лапароскопическую органосохраняющую операцию без создания ишемии почки.
Наиболее крупное исследование, посвященное сравнению открытой резекции почки (ОРП) и ЛРП, выполнили I. Gill и соавт. [4], сравнившие результаты лечения 771 пациента из группы ЛРП с результатами лечения 1028 пациентов, которым выполнили ОРП. По данным многофакторного анализа, ЛРП ассоциировалась с более коротким временем операции, меньшей кровопотерей, коротким периодом госпитализации (p<0,0001), но с длительным временем ишемии и большой частотой послеоперационных осложнений (p<0,0001) (табл. 4).

У большинства больных, перенесших ОРП, опухоли были более 4 см в диаметре с центральным расположением (p<0,0001). Функция почек через 3 мес после операции была сопоставима в обеих группах: ЛРП — 97,9% и ОРП — 99,6% [4].
В другом исследовании I. Gill и соавт. [5] с 1999 по 2008 г. у 800 пациентов, которым выполнили ЛРП, течение послеоперационного периода, частота осложнений и функция почек значительно изменялись вследствие разного подхода к отбору больных. Авторы ретроспективно разделили 800 пациентов на 3 хронологических группы: 1) сентябрь 1999 г. — декабрь 2003 г., 2) январь 2004 г.— декабрь 2006 г., 3) январь 2007 г. — ноябрь 2008 г. и оценили проспективно полученную информацию, включающую характеристику опухоли, послеоперационный исход и функцию почек. Сравнение периодов показало, что опухоли в более позднем периоде имели чаще размер 4 см и более и были центрально расположены, редко — менее 4 см в диаметре и периферически расположены. При этом время тепловой ишемии было короче (31,9; 31,6 и 14,4 мин соответственно, p<0,0001) а частота послеоперационных и урологических осложнений значительно ниже. Частота положительного хирургического края составила 1,0, 1,0 и 0,6% соответственно. За 9-летний период выполнения ЛРП характеристика опухоли и послеоперационный исход значительно различаются. Несмотря на повышение сложности удаления опухолей в современной практике такие основные параметры, как течение послеоперационного периода, время ишемии, частота осложнений и функция почек значительно улучшились. В настоящее время авторы выполняют ЛРП при опухолях, которые ранее удаляли при ОРП [5].
При сравнении полученных нами результатов с данными литературы отмечается схожая ситуация, характеризующаяся снижением частоты осложнений (11,8%), уменьшением медианы кровопотери (100 мл) и среднего времени оперативного вмешательства (117,1 мин) за счет накопления опыта и новой методики, позволяющей достигать отличного гемостаза без ишемии почечной ткани. Несомненно, стандартная ЛРП с пережатием почечных сосудов показана при больших опухолях почки с инвазией в ЧЛС и при центральном и интрапаренхиматозном расположении опухоли.
Таким образом, сравнительный анализ стандартной ЛРП и ЛРП с использованием РЧА показал достоверные преимущества последней в формировании интраоперационного гемостаза с помощью предшествующей РЧА при выполнении органосохраняющих операций на почке.
К основным достоинствам методики относятся: отсутствие необходимости в ишемии паренхимы почки, облегченное удаление опухоли, снижение кровопотери и времени операции, а также дополнительная радиочастотная обработка края резекции с аблативной целью.
Возможные осложнения во время и после операции
- кровотечение – обычно кровопотеря при резекции составляет около 500 мл и меньше, однако, возникают и более серьезные кровопотери требующие вливания специальных растворов, либо переливания крови;
- инфекция – для предотвращения возникновения инфекционных осложнений перед операцией и после вводится антибактериальный препарат широкого спектра действия, что сводит риск возникновения этого осложнения к минимуму;
- повреждения соседних органов – крайне редко встречающееся осложнение, избежать его помогает в несколько раз увеличенный обзор операционного поля;
- послеоперационная грыжа – так же как и повреждения органов встречаются редко, в связи с тем, что отверстия после лапароскопических операций маленьких размеров;
- конверсия (переход в открытую операцию) — встречается при невозможности выполнить лапароскопическое вмешательство из-за спаечного процесса или кровотечения.
Чего ожидать после операции?
После лапароскопической резекции почки пациента переводят в отделение реанимации и интенсивной терапии (ОРИТ) под присмотр врача анестезиолога-реаниматолога для контроля жизненно важных функций (контролируется артериальное давление, частота сердечных сокращений, дыхательная функция, количество выделяемой мочи), помимо этого оценивают отделяемое по дренажам (специальным трубкам введенным в полость раны), температуру, цвет мочи и общее самочувствие больного.
Чаще всего в послеоперационном периоде возникают жалобы на:
- боли в области послеоперационной раны – большинство пациентов ощущают незначительные боли, которые зачастую не требуют медикаментозного обезболивания, что отличает от болей при открытых операций, когда требуется анальгетическая терапия;
- тошнота — чаще всего является следствием введения различных препаратов необходимых для анестезии;
- наличие уретрального катетера – необходим для контроля цвета и количества мочи, убирается уже через несколько дней.
Причины возникновения рака почки
Онкология почек представляет собой разрастание злокачественного новообразования органа. Опухоль может появиться на одной почке или сразу на обеих. Метастазы имеют тенденцию к выявлению в других органах. Специалисты утверждают, что возникновение онкологии почек связано со многими провоцирующими факторами.
- Наследственность – сказывается генетическая предрасположенность организма к развитию заболевания. Если родители болели онкологическими заболеваниями, то у детей с большой долей вероятности возможно появление злокачественных новообразований.
- Часто раковые опухоли появляются вследствие влияния радиации или частых контактов с вредными химическими веществами.
- Способствует проникновению большого количества канцерогенов в организм курение. Большинство пациентов с диагностированным раком почки привержены этой пагубной привычке.
- Ожирение способствует появлению новообразований в почечной ткани уже на ранней стадии появления лишнего веса. Пристрастие к жирной пище увеличивает риск возникновения онкологии.
- Сахарный диабет и гипертония тоже могут стать провоцирующим фактором возникновения рака почек.
- Любое грубое механическое воздействие на почки способно спровоцировать заболевание. Падения, травмы, удары в области почек могут стать причиной возникновения онкологии.
- Чрезмерное увлечение лекарствами и бесконтрольное употребление лекарственных веществ увеличивает риск появления рака почек.
- Хронические заболевания вирусной этиологии и проблемы, связанные с их лечением, провоцирует появление злокачественных опухолей.
Однозначной причины возникновения злокачественных новообразований до сих пор никто не установил. Существует множество точек зрения на этот вопрос. При несомненных успехах в лечении рака почек в Москве, говорить о полной, 100% победе над раком еще рано. Победить раковые заболевания ученые смогут только после того, как будут открыты универсальные механизмы канцерогенеза и способа исключения развития злокачественных опухолей.
Что делать в послеоперационном периоде?
В среднем пациент приводит в больнице около недели после лапароскопической резекции почки. Пить и есть разрешают обычно на следующий день после операции, ходить — вечером того же дня. После операции, как и до нее, вводится антибактериальный препарат широкого спектра действия.
В послеоперационный период вам будет рекомендовано:
- пить по 1-2 литра воды в день;
- не поднимать вес более 5 кг;
- не подвергаться тяжелой физической нагрузке.
Необходимо срочно обратиться к врачу, если у вас:
- появилась кровь в моче;
- повысилась температура тела;
- возникли сильные боли в животе.
После операции ваш доктор назначит вам даты консультаций для проведения осмотров, сдач анализов крови и мочи, проведения ультразвукового исследования, компьютерной томографии, где будет оцениваться эффективность лечения. Через 5 лет, при отсутствии данных за наличие опухолевой прогрессии, пациента снимают с учета.
Записаться на прием в клинику урологии Первого МГМУ им. Сеченова к врачу урологу, онкологу, доктору медицинских наук Акопяну Г. Н. вы можете по телефону или через интерактивную форму Запись на прием на нашем сайте.
11 сентября 2019
Акопян Гагик Нерсесович — врач уролог, онколог, д.м.н., врач высшей категории, профессор
Все клинические наблюдения…